ブリッジレポート:(7776)セルシード vol.29
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
橋本 せつ子 |
||
所在地 |
東京都江東区青海二丁目5番10号 テレコムセンタービル |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2016年12月 | 100 | -1,413 | -1,415 | -1,414 |
| 2015年12月 | 193 | -568 | -531 | -535 |
| 2014年12月 | 86 | -601 | -577 | -582 |
| 2013年12月 | 105 | -534 | -581 | -584 |
| 2012年12月 | 75 | -846 | -842 | -913 |
| 2011年12月 | 86 | -1,418 | -1,358 | -1,442 |
| 2010年12月 | 66 | -1,204 | -1,002 | -1,009 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(11/24現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
  【再生医療とセルシードの戦略】
再生医療とは、失われた臓器や損傷、或いは機能が低下した臓器を再生して治療する新たな医療。様々な細胞に分化できる能力を持った幹細胞が鍵となる。現在、受精卵から作られる「ES細胞」、人口多能性細胞「iPS細胞」、及び生体の様々な組織にある「体性幹細胞」、の3つの種類の幹細胞がある。「ES細胞」は受精卵から作られるため全ての細胞に分化する能力を持っているが、受精卵から作られるため倫理的な問題があり、実用化に至っていない。「iPS細胞」は、皮膚等の分化した細胞に4つの遺伝子を導入して培養した人口多能性細胞であり、京都大学の山中教授のノーベル賞受賞以降、研究が加速した。しかし、分化のプロセス等、未だ解明されていない部分が多く、実用化には時間を要すると言われている。一方、「体性幹細胞」は同社が実用化に最も近いと考えている幹細胞である。同社は食道や膝の軟骨に近い部分の細胞を「細胞シート工学」を用いてシート状に培養し、患者に移植するという治療(食道や膝軟骨の再生医療製品)の開発に取り組んでいる。具体的には、2018年の販売承認申請提出を目指して「食道再生上皮シート」の治験を進めている他、「軟骨再生シート」の2017年の治験開始に向けた準備も進めている。「細胞シート工学」を用いた再生医療製品は、食道や膝軟骨にとどまらず、角膜、歯、耳、肺、心臓、肝臓、及びすい臓の治療でも臨床研究が進められており、既に臨床データも有する。 また、2015年9月には、(株)セルシードの温度応答性細胞培養器材「アップセル」が組み込まれているテルモ製「ハートシート」(心臓の再生医療に用いる)が期限付き承認を取得した。(株)セルシードは「ハートシート」専用(特注品)の温度応答性細胞培養器材「アップセル」の供給責任を負っている。 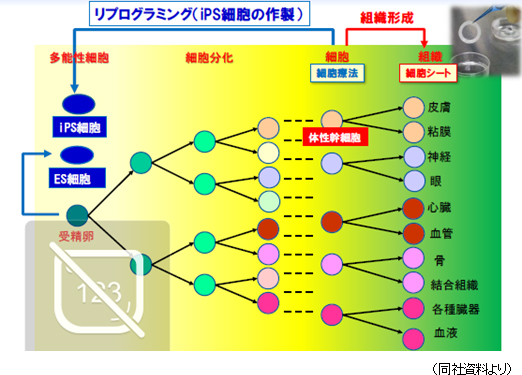 |
| 中期経営計画(17/12期~19/12期)と進捗状況 |
|
【中期経営計画の6本の柱と数値目標】
(1)食道再生上皮シートの承認取得・販売開始、(2)同種(他家)軟骨再生シートの開発加速、(3)次期品目の開発着手、(4)サプライチェーン体制の構築、(5)再生医療支援製品の新製品開発・収益機会獲得、及び(6)海外企業との事業提携推進、の6本の柱を掲げている。(1)食道再生上皮シートの承認取得・販売開始については、18年販売申請、19年承認取得を予定しており、国内で先駆け審査指定制度対象品目に指定され(販売承認申請から承認取得までの期間が6か月短くなる)、欧州ではデバイスCEマーク(欧州への輸出が可能になる)を取得した。(2)同種(他家:他人の細胞を培養したシートを利用)軟骨再生シートの開発加速については、17年2月に第1例目の臨床研究が始まり、今後3年間で10名の患者への移植を計画している。また、17年6月にAMED「再生医療の産業化に向けた評価基盤技術開発事業」に採択され、開発補助金を受ける事になった。(3)次期品目の開発着手については、現在、調査・検討中。(4)サプライチェーン体制の構築については、同社の細胞培養センターが17年3月に「特定細胞加工物製造許可」(許認可権者:厚生労働省)を取得し、特定細胞加工物の受託製造が可能になった。(5)再生医療支援製品の新製品開発・収益機会獲については10月にHydroCellフラスコやUpCellの新製品を発売した。(6)海外企業との事業提携推進については、台湾企業と総額12.5億円の事業提携契約を締結し、9月に入金が始まった。  ただ、上記の数値目標は台湾企業との事業提携契約締結前に策定されたため、定型一時金12.5億円等の海外事業提携関連の収益は織り込まれていない(提携関連の売上高は現在協議中の案件も含めて織り込んでいない)。 【細胞シート再生医療パイプライン】
食道がん再生治療法(食道創傷治癒・狭窄予防)として東京女子医大先端研が開発した治療法である。患者の口腔粘膜から採取した細胞を温度応答性培養器材で約2週間かけて培養し、細胞シートを作成する。細胞シートの培養に合わせて、食道がん切除内視鏡手術を行い、食道潰瘍面に移植する。(1)「食道再生上皮シート」 同社の説明によると、日本では、年間約22,000人が食道がんと診断され(日本では食道がんの90%が扁平上皮がん)、年間約11,500人が食道がんで死亡している。また、男性の発症率・死亡率は女性の5倍で、5年後の生存率は男性36%、女性44%、と男女共に低い。治療法として、2008年に保険収載された内視鏡切除手術(ESD)が増加しているが(食道がんと診断された患者の約20%が毎年手術を受けている)、ESDは手術後の食道狭窄の副作用がある。 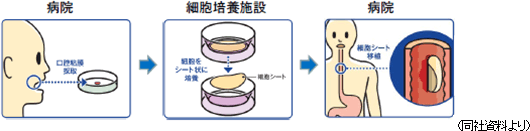 先駆け審査指定制度の対象品目に指定
2017年2月に、厚生労働省「先駆け審査指定制度」対象品目に指定された。対象品目に指定されると、薬事承認に係る相談・審査での優先的な取扱いに加え、製造体制の整備に係る指導や承認後に円滑に医療現場へ提供するための対応を受ける事ができる(優先相談、事前評価、優先審査、審査パートナー制度といったメリットがある)。
細胞シート移植用デバイスの欧州医療機器指令適合のEC認証取得
2017年10月、細胞シート移植用デバイスについて、医療機器に特化した品質マネジメントシステムに関する国際規格「ISO 13485」の認証を含む欧州医療機器指令への適合のEC 認証を取得した。認証取得は提携先のMetaTech 社が台湾で事業化を進めている食道再生上皮シート事業(後述)にも追い風となる。同社は食道再生上皮シートの海外展開を加速させて行く考えだ。尚、細胞シート移植用デバイスは安井株式会社(宮崎県東臼杵郡門川町大字加草2725 番地)に製造を委託している。 (2)軟骨再生シート
「軟骨再生シート」は、東海大学整形外科佐藤正人教授との共同研究であり、スポーツによる損傷や加齢を原因とする軟骨欠損や変形性関節症を適応症とする。現状では根治する方法がないが、佐藤教授との共同研究は軟骨表面の根本的な再生を目的としている。膝の軟骨は、硝子(しょうし)軟骨と言い、耳や鼻等の軟骨とは異なり、クッション性と対摩耗性に優れた硬い軟骨で再生が難しい。しかし、共同研究を進めている「軟骨再生シート」は、硝子軟骨として膝の軟骨を再生できる事が臨床研究で確認されている。
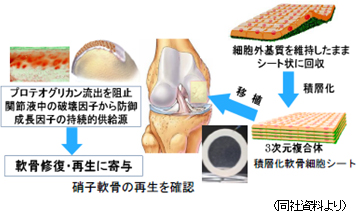
同社の資料によると、変形性膝関節症とは、緩徐に進行する難治性の関節軟骨変性。国内における患者数(40歳以上)は2,530万人、そのうち有症病者は800万人と推定されている(東京大学医学部附属病院22世紀医療センター調査)。また、高齢化により患者数の増加が予測され、国民健康寿命・介護費・医療費の観点から喫緊に対処すべき疾患であると言う。
平成25年厚生労働省国民生活基礎調査によると、要支援・要介護になった原因の25%を運動器の障害が占めた。
東海大学との共同研究
2011年8月に自己細胞シート移植の臨床研究が第65回厚生科学審議会科学技術部会で承認され、同年10月の厚生労働大臣の意見書(厚生労働省発医政1003第3号)発出を受けて、同年11月に第1例目臨床研究が始まった。そして、2015年11月に8例の2年後評価が終了した(現在、移植施術後3年以上が経過したが、いずれも術後経過は良好)。東海大学とは、開発基本合意書(同社が国内外で開発する権利を有する事の合意)及び共同での特許の出願の合意書を取り交わしている。特許については、既に国内特許が成立し、海外特許が審査中である。今後、更に特許網を広げていく考え。販売承認の許認可機関である独立行政法人医薬品医療機器総合機構(PMDA)との薬事戦略相談も始まっており、アドバイスを受けているが、更に相談を重ね、安全性データの蓄積と臨床プロトコルの確立に取り組んでいく考え。 同種細胞シート移植についても、2017年2月15日に第1例目の臨床研究が始まった(移植手術を実施)。この臨床研究は、多指症患者から軟骨組織を採取し、2~3週間かけて培養した細胞シートを移植するもので(先天的に手の指が6本ある乳児から切除された指の軟骨細胞を同意を得て利用)、今後3年間で10名の患者への移植を計画している。細胞の培養については、セルシードの細胞培養センターでの培養が協議されている。 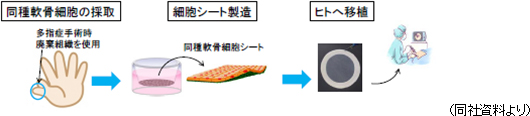 【海外展開】
2017年4月に、三顧股(1)台湾での事業提携契約 最初のパッケージデータである「製造関連データ」を提供開始に伴い、9月に入金(60百万円)があった。このパッケージデータの提供は来期(18/12期)を予定しており、提供完了時には別途40百万円を受領する。9月に入金した60百万円と合わせて来18/12期に売上計上(1億円)される。MetaTech社との契約では数種類のパッケージデータを設定しており、順次提供していく。 (2)海外事業提携候補先の探索
MetaTech社以外にも海外事業の提携ネットワークを広げるべく、展示会への出展で携候補先の探索を行っている。17/12期は、BIO International Convention、Nordic Life Science Days 2017、及びCell and Gene Meeting on the Mesa 2017に出展した。展示会で面談した企業や団体とはフォローアップの協議を重ねている。
Nordic Life Science Days 2017 スウェーデン・マルメ 2017年9月12日~14日 Cell and Gene Meeting on the アメリカ・カリフォルニア 2017年10月4日~ 6日 Mesa 2017 【資金調達】
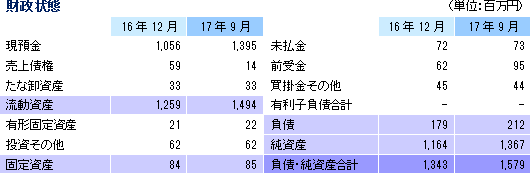
2017年3月6日に、Evolution Biotech Fund を割当先とする新株予約権(第16回、2,200千個)を発行した。第3四半期末現在、新株予約権1,800個が行使され、2017年10月3日までに残る400個が行使された(全権2,200千株の行使完了)。第3四半期末の総資産は新株予約権の行使による現預金と純資産の増加で15億79百万円と前期末と比べて2億36百万円増加した。純資産は、新株予約権の行使により資本金及び資本剰余金がそれぞれ4億36百万円増加する一方、四半期純損失6億74百万円を計上した事等で利益剰余金が6億74百万円減少した。
 |
| 2017年12月期第3四半期決算と通期予想 |
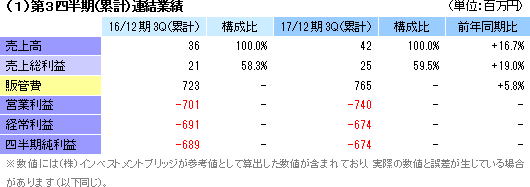 研究開発費の増加で営業損失が増加
再生医療支援事業で42百万円の売上を計上し、細胞シート再生医療事業での売上計上はなかった。損益面では、年内販売開始予定の同社独自の技術による温度応答性細胞培養器材の新規商材の開発及び販促費等で再生医療支援事業が78百万円の営業損失となり(前年同期は営業損失65百万円)、食道再生上皮シート及び軟骨再生シートの細胞シート再生医療製品パイプラインの自社開発を中心とした研究開発を進めた細胞シート再生医療事業が4億27百万円の営業損失(前年同期は営業損失4億11百万円)。この他、調整額2億34百万円(同2億24百万円)。連結ベースでの研究開発費は4億38百万円と前年同期の3億93百万円から11.4%増加した。また、パシフィコ横浜で開催された、「第76回日本癌学会学術総会 付設展示会」(2017年9月28日~30日)において、温度応答性細胞培養器材の新規商材の発表を行った。 (2)2017年12月期予想
通期予想に変更はなく、売上高1億円(16/12期 売上高1億円)、営業損失12億50百万円(同 営業損失14億13百万円)、経常損失12億30百万円(同 経常損失14億15百万円)、当期純損失12億30百万円(同 当期純損失14億14百万円)。17/12期は食道再生上皮シートの開発費(治験等の費用)がピークとなる。
|
|
| <参考:コーポレートガバナンスについて> |
 ◎コーポレートガバナンス報告書 更新日:2017年04月05日
基本的な考え方
当社は、技術革新と創造性を発揮し、質の高い優れた製品とサービスの提供を通じ人々の健康と福祉に貢献していくことを使命とし、全ての企業活動において品質を高めるべく企業統治の整備を進めています。今後につきましては、ディスクロージャーの透明性を高めるため一層説明責任を充実するとともに、さらなる経営のチェック機能強化を図ってまいります。 【コーポレートガバナンス・コードの各原則を実施しない理由】
当社は、JASDAQ上場企業としてコーポレートガバナンス・コードの基本原則をすべて実施しております。
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2024 Investment Bridge Co.,Ltd. All Rights Reserved. |



