がん領域に特化したスペシャリティ・ファーマ(※)として、有望市場である日本、中国を中心としたアジア地域においてがん治療薬、がんサポーティブケア(がん支持療法医薬品等)などの開発及び販売を行う。
荒井社長率いる実務経験豊富な開発スタッフ、開発成功確率の高さ、安定した事業基盤、事業の早期実現可能性などが大きな強み・特長。
(※)スペシャリティ・ファーマ:得意分野において国際的にも一定の評価を得る研究開発力を有する新薬開発企業のこと。
 【1-2 企業理念・経営理念】
【1-2 企業理念・経営理念】
社名のソレイジア(SOLASIA)は、Sol(ラテン語で太陽)+Asia(アジア地域)からなるもので、「日本・アジアにおいて、
がんと向き合うさまざまな人たちの未来を照らす希望の太陽でありたい。」という想いを表している。
以下のような、『経営理念:ミッション、ビジョン、バリュー』を掲げている。

また、経営方針として以下の2点を示している。

ニッチではあるが困っている患者が多数いるアンメット・メディカル・ニーズ(いまだに治療法が見つかっていない疾患に対する医療ニーズ)解決のための新薬開発に注力していく。
また、現在は研究開発が先行しているため財務CFに頼らざるを得ない現状であるが、早期に営業CF黒字化を実現し、持続的成長が可能な基盤を構築する。
【1-3 同社を取り巻く環境】
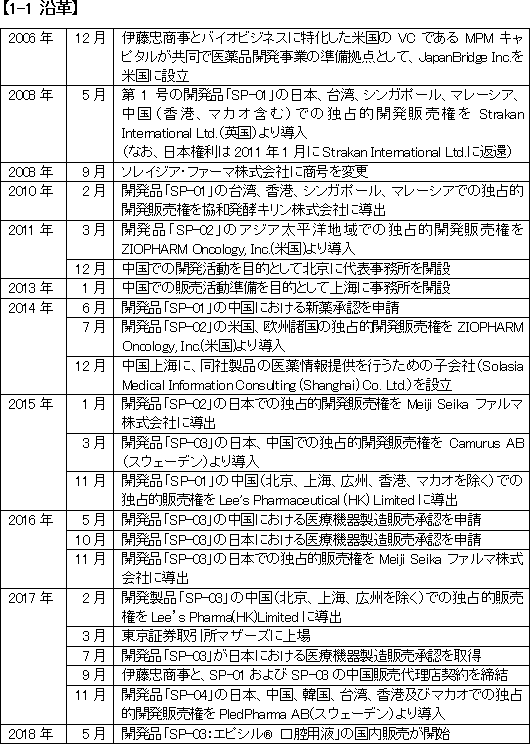
厚生労働省「平成27年(2015)人口動態統計」によれば、2015年の死因別順位は悪性新生物(がん)が、死亡数370,346人で全死亡者数1,290,444人の28.7%を占め第1位であった。
総人口の変化を加味した「死亡率(人口10万人に対し何人が死亡したか)」の推移を見ても、1981年に死亡率142.0人で、同134.3人の脳血管疾患に代わり第1位となって以来30年以上にわたり連続して第1位であり、その数値も年を追って上昇、2015年は295.5人となっている。
高齢化、また食生活を含めたライフスタイルの変化等によりがん発症率は上昇していると言われているが、中国においてもがんの発症者数及び死亡者数は増加傾向にある。
現在の国別医薬品市場規模は1位が米国で、中国が第2位だが、2020年には中国市場は米国市場と1位を分け合う規模まで拡大するとも言われている。
こうしたがんによる死亡率の上昇に伴い、「新規抗がん剤」および「がんサポーティブケア」への期待が高まっている。
(新規抗がん剤)
抗がん剤を用いたがん治療においては、一つの抗がん剤のみを用いる単剤治療よりも、複数の抗がん剤を用いる併用療法のほうが主流である。
加えて、がんは種類によって異なるが、再発の可能性が高く、加えて難治の場合は、一種類の治療での治癒は困難であるため、一つの治療薬が絶対的な存在とはならず、他の治療薬が直接的な「競合」とはなり難いという特性がある。
また、近年では、分子標的薬や免疫療法が注目されてはいるが、まだ多くのがん種に対する治療において化学療法剤が重用されている。殺細胞性抗がん剤を含むレジメンは標準治療として位置づけられ、今後も高い医療ニーズが期待される。
(がんサポーティブケア)
抗がん剤はがん細胞を攻撃するなどの強力な医薬品であり副作用が避けられない。
患者に負担がかかる副作用をコントロールできなければ、抗がん剤の減量やがん治療そのものを中止せざるを得ず、結果的には病状が進行してしまうリスクがある。
こうした事態を避け、がん治療を完遂するためには、副作用のコントロールを行うための医薬品や医療機器への期待が高まっている。
また、がんの治療薬はがんの種類ごとに承認を得なければならないが、サポーティブケアはがんの種類を問わず、幅広いがん患者への処方が可能であり、大きなニーズ、市場が見込まれる。
以上のように、日本・中国におけるがん治療ニーズの増大とそれに対応した新規抗がん剤およびがんサポーティブケアへの期待は大きく、同社はこうしたニーズを取り込み、収益を拡大させるためのビジネスモデル、事業戦略を構築している。
【1-4 事業内容】
(1)ビジネスモデル
新しい医薬品が上市されるまでには、「基礎研究」から始まり、「製剤研究」、「非臨床開発(動物を用いて薬効薬理作用、生体内での動態、有害な作用などを調べる試験)」、「臨床開発(医薬品や治療技術などの人間への影響を調べる科学的試験)」を経て、当局の承認を得たのち、「製造」、「販売・マーケティング・製造販売後調査」といったプロセスを経るのが一般的である。
大手製薬会社は、巨額な研究開発費を変動費化することなどを目的にCROを利用した臨床開発段階のアウトソーシングを進めてはいるが、基本的には上記の工程全てを自社内に保有している。
これまではこうした体制が製薬会社の高収益体制を支えてきたが、近年の生命科学分野の急速な進歩や複雑化、多様化により、自社固有の創薬技術が陳腐化してしまう可能性が高まっている。
また、多額の費用と時間をかけて基礎研究から進めても臨床開発に入るまでに実用化を断念し、創薬技術を確立できないケースも多く、医薬品開発には常に高いリスクがついてまわる。
そこで同社では、失敗の確率の高い基礎研究から非臨床開発の工程を自社では行わず、まだ開発段階にある将来有望な医薬品を外部から導入して臨床開発から開発に着手。それ以降の事業活動に経営資源を集約することで自社の強みを発揮するとともにリスクの低減を図っている。
現時点ではコスト負担の大きい製造工程も保有しない計画である。
販売工程については、高収益確保とリスクコントロールのバランスを考慮した仕組みを構築している。
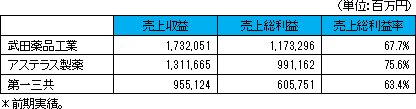
一般的に製薬企業の売上高総利益率は高水準であるが、これは、製造および販売活動を内製化することによって実現できると考えられる。
一方医薬品は販売地域の網羅性(例:日本全国をカバー)が要求され、自社販売網を構築しようとすれば、固定費が増大する。
そこで同社では、臨床開発を終えた医薬品について、「自販モデル」と、販売権を他社に導出する「導出モデル」を併用している。
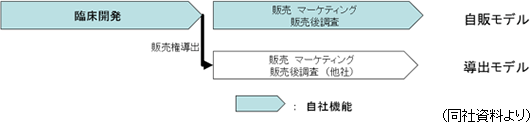
(自販モデル)
中国の3大都市「北京・上海・広州」においては自社販売体制を構築し自販モデルを展開する。
この3都市の人口合計は中国全人口の約5%に過ぎないが、抗がん剤を取り扱うのは最先端かつ大病院であるため、大病院が集中するこの3都市は中国の抗がん剤市場の3割を占める巨大マーケットである。
また、新しい医薬品の使用・普及にあたっては影響力のある医師の判断や決定がその結果を大きく左右する。こうした影響力のある医師の在籍する大病院への営業活動は極めて重要なポイントとなる。
加えて、中国全土ではなくあくまでもそれぞれの都市における営業であり、少人数の販売組織でも十分に活動は可能である。現在約50-60の大病院を対象とした営業スタッフ増強に動いている。

今後も共同歩調が取りやすくWIN-WINの関係を構築できる中堅製薬メーカーを中心に導出先パートナーとして確保していく考えだ。
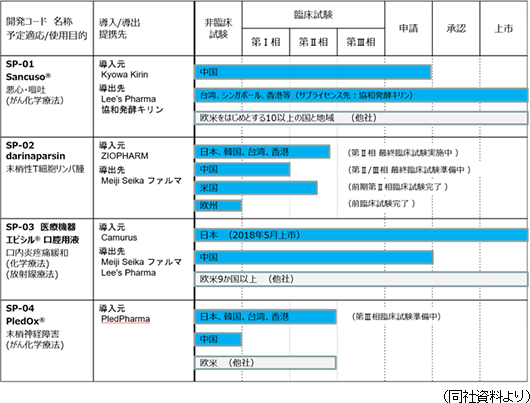
(2)開発パイプライン
現在、前述の経営方針に沿って以下4つの開発パイプラインを有している。
 (対象疾病の概要)
(対象疾病の概要)
抗がん剤の代表的な副作用として悪心や嘔吐はよく知られている。
抗がん剤を投与すると、小腸にあるクロム親和性細胞と呼ばれる細胞がダメージを受ける。
ダメージを受けたクロム親和性細胞はセロトニンという神経伝達物質を放出。これが末梢の迷走神経上にある5-HT3受容体に取りこまれ、その刺激が末梢の迷走神経に沿って、脳の第4脳室最後野にある化学受容器引金帯(CTZ)を介して延髄に入り、悪心・嘔吐の命令を生体に出す嘔吐中枢を刺激し、悪心や嘔吐が発現する。
悪心・嘔吐を抑制するためにはセロトニンによる5-HT3受容体への刺激を遮断することが必要であり、そのために用いられる薬剤「5-HT3受容体拮抗薬」としては様々なものがあるが、代表的な薬剤がグラニセトロンである。
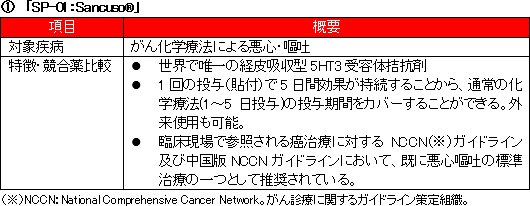
(「SP-01」概要)
「SP-01」は、このグラニセトロンを含んだ5-HT3受容体拮抗薬の経皮吸収型製剤(貼付剤)で、貼り薬としては世界唯一。
抗がん剤は5日間にわたり投与するケースが多いが、注射や経口による制吐剤は概ね1~2日間しか効果がなく、抗がん剤投与期間内に複数回注射しなければならない。
これに対し「SP-01」は5日間にわたって安定的に血中のグラニセトロン濃度を維持することができるため、1回貼り付ければ制吐剤を追加する必要がなく、入院ではなく外来によるがん治療を可能とするため、患者のQOL向上にも大きく貢献する。
悪心・嘔吐、口内炎などが原因で、薬剤の服用が困難な状態にある場合でも、経皮吸収型製剤は使用可能である点も大きなメリットであり、以上のような点を評価され、米国NCCN診療ガイドライン、中国治療ガイドラインで処方推奨を得ている。
(開発および販売状況)
現在上市済の地域は、米国、英国、ドイツ、イタリア、オランダ、デンマーク、フィンランド、ノルウェー、スウェーデン、クウェート、レバノン、カタール、バーレーン、アラブ首長国連邦、サウジアラビア、韓国、フィリピン、(以上、導入元等が販売)、台湾、香港、シンガポール、マカオ(以上、同社サブライセンス先の協和発酵キリンが販売)など多数にわたっている。今後は、がん化学療法だけでなく放射線療法による悪心・嘔吐抑制への適応拡大を見込んでいる。中国での承認申請は2014年6月に完了し現在は承認審査中。2018年上半期(1~6月)での承認、その後の販売開始を見込んでいる。
 (対象疾病の概要)
(対象疾病の概要)
悪性リンパ腫は、血液がんの1つで、白血球の中のリンパ球ががん化したもの。
リンパ球には、B細胞、T細胞、NK細胞等の種類があり、これらががん化して無制限に増殖することで発症する。
末梢性T細胞リンパ腫(PTCL:Peripheral T-cell lymphoma)とは、悪性リンパ腫の種類の1つ。リンパ球の中のT細胞から発生するもので、月単位で病気が進行する「中悪性度」に分類され、中悪性度リンパ腫の10~15%を占めるといわれている。
B細胞リンパ腫などに比べ、5年生存率は低く、25%前後である。
(開発および販売状況)
「SP-02」は、この末梢性T細胞リンパ腫(PTCL)への適応で開発をスタートさせた。
2015年10月までに米国や日本、韓国等にて187名の被験者に投与される実績を有する。
米国における前期第Ⅱ相臨床試験は2012年4月に完了し、白人種における一定の有効性を確認した。
2015年4月に完了した日本および韓国における第Ⅰ相臨床試験では、PTCL患者において安全性及び忍容性が確認され、アジア人種における一定の有効性が示唆された。
2016年にスタートした日本、韓国、台湾、香港での最終試験として位置づけられる第Ⅱ相国際共同臨床試験が進行中で、2018年末までに終了の予定。中国においては最終試験である第Ⅱ/Ⅲ相臨床試験の準備中である。
悪性リンパ腫はしばしば再発することが知られており、作用機序の異なる複数の治療薬が必要でマーケットは大きいと同社は考えている。
末梢性T細胞リンパ腫のみでなく、その他血液がん(リンパ腫、白血病)や固形がんへの適応拡大を目指しており、2019年以降の開発開始を予定している。
日本での開発販売権はMeiji Seika ファルマ株式会社に導出済で、欧米及び中国では導出先を選定中である。
 (対象疾病の概要)
(対象疾病の概要)
抗がん剤による悪心・嘔吐と並んで、癌化学療法又は放射線療法による口腔粘膜障害の副作用も患者にとっては大きな困難である。
口内炎は、「化学療法が口腔粘膜へ直接作用して障害が生じるもの」や「放射線照射により唾液腺組織に障害が生じ、唾液の分泌低下により口腔内の自浄作用が低下し局所感染が起こることで発生するもの」である一次口内炎と、「白血球減少などに伴う骨髄抑制により起こる口腔内感染が原因となるもの」である二次口内炎がある。
抗がん剤治療に伴う口内炎の発生頻度は30~40%、抗がん剤と頭頸部への放射線治療併用時の口内炎発生頻度は約100%となっている。
癌化学療法又は放射線療法による口内炎は、300~500もの多数の炎症が発生する。その疼痛により患者は食事や水分の経口摂取が困難になり体力低下を招き、重症化すると本来のがん治療の継続にも悪影響を及ぼしてしまう。
ただ、現在のところ標準的な対処法はなく、各病院ごとでの対症療法に頼っているのが現状である。
(「SP-03」概要)
「SP-03」は、脂質ベースの液体を口腔粘膜に滴下塗布するものであり、同社ではカテゴリーとしては医療機器として開発を進めてきた。
口腔粘膜に適量を適用すると、数分以内に液体が口腔内の水分を吸収し生体接着ゲル化し、物理的なバリヤーを形成するもので、8時間程度の口内炎の疼痛緩和効果が臨床的に示されている。
2016年に日本における承認申請を完了していたが、2017年7月6日付けで、厚生労働省より、日本国内における医療機器製造販売承認を取得した。2018年1月には第388回中央社会保険医療協議会総会において18年4月からの保険適用が承認され、保険収載を経て、18年5月、日本における独占販売権の導出先であるMeiji Seika ファルマ株式会社による販売が開始された。なお、中国においても2016年5月に医療機器製造販売承認申請を当局に行っており、2018年中の承認、その後の販売開始を計画している。
北京、上海、広州では自社販売を、その他の中国地域についてはLee’s Pharma社へ販売権を導出している。
日本以外では、米国、英国、ドイツ、デンマーク、ノルウェー、スウェーデン、フランスなどで他社及び導入元により販売されている。

先行する3つの開発がおおむね順調に進む中、4つ目のパイプライン導入を上場時から検討していた同社は、「がん領域である。」、「臨床試験が一定程度進んでいる。」、「日本及び中国での開発権利を獲得できる。」という3つの条件を満たす新薬を探していた。そして、2017年11月にスウェーデンのPledPharma AB(以下、「Pled 社」)から、がん化学療法に伴う末梢神経障害薬「PledOx®」の日本、中国、韓国、台湾、香港及びマカオでの開発事業化の独占的権利を獲得した。早期の承認取得を実現するため、まず大腸がん治療における代表的な抗がん剤「オキサリプラチン」投与による末梢神経障害に適応を絞り、日本や中国など東アジア地域での臨床開発を進めていく。
(対象疾病の概要)
がん化学療法は、悪心・嘔吐や口内炎発症等の副作用が生じるが、末梢神経障害も重篤な副作用の一つ。
末梢神経障害は、プラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤において、顕著に発現することが知られている。
大腸がんのうち手術による治癒が難しい進行・再発がん(ステージⅢ、Ⅳ)に対する化学療法及び術後補助化学療法における代表的な治療法であるFOLFOX療法は、フルオロウラシル・フォリン酸・オキサリプラチンの 3 剤を併用するものだが、このうちオキサリプラチンの処方は、患者の約9割で「手、足や口唇周囲部等の異常感覚」、「呼吸困難や嚥下障害を伴う咽頭喉頭の絞扼感(しめつけ)」、「手足先のしびれ」、「感覚低下」、「感覚性運動失調」などの症状を伴う末梢神経障害を生じさせる。
このような副作用が発現した場合には、薬剤中止により、80%の症例では一部症状の改善がみられ、40%の症例では 6~8 ヶ月後には完全に回復するが、薬剤中止はがん化学療法の中止や方針変更となる可能性があり、末梢神経障害の治療は医療上の重要な課題である。
ただ、がん化学療法の副作用としての末梢神経障害を適応として当局に承認された医薬品は現時点では存在していない。
(「SP-04」概要)
「SP-04:PledOx®」の導入元Pled 社はストックホルム証券取引所に上場しており、酸化ストレス関連の疾患に対する医薬品開発に強みを持つ。
「PledOx®」(一般名:Calmangafodipir)は欧米で販売実績を有するMRI造影剤「Mangafodipir」を基に創生された新有効成分である。
後述のように「SP-04:PledOx®」は後期第Ⅱ相臨床試験を終了し、今後、第Ⅲ相国際共同臨床試験が開始される予定で、末梢神経障害薬のトップランナー。開発成功は大きな先行者利益獲得につながるだけでなく、がん患者のQOL向上など社会的貢献度も高い。
*市場性
ソレイジア・ファーマによれば、FOLFOX療法の対象となる大腸がん患者数は年間で日本6~10万人、中国20万人程度と推定している。
FOLFOX療法は、「3日間の治療、11日間の休薬期間」の計14日間が1サイクルであり、それを12サイクル行う治療法である。
対象疾患はオキサリプラチン投与を含むがん化学療法の対象となる大腸がんであるが、オキサリプラチン以外のプラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤においても末梢神経障害が顕著に発現することがしられており、乳がん、肺がん、卵巣がん、膵臓がんなど大腸がん以外の固形がんも追加対象疾患となれば、市場性は更に広がると同社は想定している。
*開発状況
Pled 社は、これまで末梢神経障害を適応として PledOx®の研究開発を欧米で行ってきており、後期第Ⅱ相臨床試験までの結果、FOLFOX療法を受けている進行性大腸がん患者において、有効性と安全性、つまり末梢神経障害を改善する効果およびFOLFOX 療法によるがん治療そのものへの影響を生じさせないこと等についての効果が示唆されている。Pled 社は、日本への導出を検討した際、日本人を対象とした臨床試験が必要と判断したため米国で日本人を被験者とするPledOx®の第Ⅰ相臨床試験を実施してきたが、18年2月、この第Ⅰ相臨床試験は終了し、SP-04の日本人における良好な安全性及び忍容性が確認された。
Pled 社は、FDA(米国食品医薬品局)及び EMA(欧州医薬品庁)との協議を経た第Ⅲ相国際共同臨床試験への被験者登録を2018年下半期(7-12月)に開始する予定であると発表している。
日本人を被験者とする第Ⅰ相臨床試験が終了したソレイジア・ファーマは日本当局と協議の上、この第Ⅲ相国際共同臨床試験に参画したいと考えていたが、2018年6月、PMDA(独立行政法人医薬品医療機器総合機構)との協議を経て、ソレイジア・ファーマの権利地域である日本等(日本・韓国・台湾・香港)の参画を決定した。
試験の概要は以下の通り。
 ※プラセボ対照試験
薬の臨床試験において、被験者を対照群と治療群とに分け、対照群にはプラセボを割り付ける試験。 プラセボとは色、重さ、味及び匂いなどを可能な限り被験薬に似せ、かつ薬効成分を含まない「偽薬」。
※プラセボ対照試験
薬の臨床試験において、被験者を対照群と治療群とに分け、対照群にはプラセボを割り付ける試験。 プラセボとは色、重さ、味及び匂いなどを可能な限り被験薬に似せ、かつ薬効成分を含まない「偽薬」。
第Ⅲ相国際共同臨床試験への参画が決定されたことで、「SP-04」の事業化はソレイジア・ファーマ単独で臨床試験を実施する場合、第Ⅲ相臨床試験に先立ち第Ⅱ相臨床試験を実施する場合と比べ、時間、費用とも大幅に短縮、抑制されることが見込まれる。
以上4つのパイプラインの開発・事業化の経緯、現状、今後の計画は以下のとおりである。
 【1-5 バイオベンチャーとしての6つの特徴】
【1-5 バイオベンチャーとしての6つの特徴】
バイオベンチャーとしての同社を特徴づけるのは主に以下の6点である。
①創業の経緯
同社のスタートは、伊藤忠商事と米国のバイオに特化したVCであるMPMキャピタルによって設立された「JapanBridge (Ireland) Limited」。数社のバイオベンチャーから新薬の権利を導入し、開発を進めた。
当初はExitとして製薬会社への売却を中心に考えていたが、4-5年ほど前からは事業の将来性、有望性から企業として永続的に事業を展開する方向にシフトし、研究開発に向けた資金調達も必要なため株式公開の道を選択した。
もともと他社への売却を念頭に置いていたことから、保有する開発品は開発段階ではあっても他社に売却して現金化可能な優良な資産で構成されており、創業時より既に強固な事業基盤を構築している。
②実務経験豊富な臨床開発陣
研究部門や前臨床部門を持たず、新薬開発の権利導入を活用し、臨床開発以降の医薬品創造プロセスに特化している。医薬品事業化への研究開発過程において最も大切なのは最終的に当局の承認を取得することであるが、そのためには臨床開発、特に第Ⅱ相以降の後期臨床段階におけるスキルやノウハウが最も重要である。
数多い日本のバイオベンチャーの中でも、社長が臨床開発をコアスキルとして身に付け、強力な武器としているのは同社荒井社長以外には見当たらない。
荒井社長率いる実務経験豊富な臨床開発スタッフは同社の強力な差別化要因、競争優位性である。
③開発成功確率の高さ
直近導入した「SP-04」に先立ち、「SP-01」、「SP-02」、「SP-03」という3つの開発品を導入しているが、開発中止や失敗実績はなく、3つの開発品全てが事業化に至る最終段階(1つは日本で販売開始、1つは承認申請済、1つは最終臨床試験実施中)にある。
この高い開発成功確率を可能にしているのは2つの要因である。
1つ目は、失敗のリスクの低いものを選定し導入するビジネスモデル。
2つ目は、臨床開発のすべてを担うことのできるチームが社内にあること。前述のように、承認を取るためには何が必要かを熟知した開発陣は、導入品が承認をとれるか否かについてのスクリーニングをかけることができる。
1つ目、2つ目を合わせた、いわば「目利き力」が、開発断念に至るリスクを引き下げ、3打数3安打という高打率の源泉となっている。
新薬のキャッシュインフローをDCF(ディスカウント・キャッシュフロー)モデルから分析してみると、将来にわたるトータルのキャッシュインフローの大部分を構成するのは契約金やマイルストンではなくロイヤルティであるが、言うまでもなくロイヤリティは最終的に開発が成功し、販売が拡大しないと獲得することはできない
Pled社への提案に際し、多くの競合に比べ、契約金を始めとした金額面では決して有利ではなかったにもかかわらず今回「SP-04」を導入できたのも、明確な臨床開発設計を構築できるチーム力、先行3製品の開発実績、日本・中国を含めたアジアでの実績などをPled社が評価し、ソレイジア・ファーマがアジアにおける「PledOx®」成功のためのベストパートナーと判断したものであろう。
④安定した事業基盤
前述のように開発品3つ全てにおいて、製薬企業への販売権導出を達成しており、自社販売と組み合わせたリスクヘッジのためのポートフォリオを構築済である。
⑤高利益確保のための自販体制
製薬会社が高い収益性を実現できているのは、自社で製造・販売双方を手掛けているためだ。
同社は現在のところ製造設備は保有していないが、収益性を高めるためにマーケットが大きくかつ効率的に営業活動が展開できる中国の三大都市(北京、上海、広州)に自社販売体制を構築中である。
⑥事業の早期実現
バイオベンチャーの場合、新薬開発段階では損失を計上しているのが一般的であるため、株価や事業価値の算定において損益計算書を使用することは合理的ではなく、DCFモデルを使用することとなるが、バイオベンチャーを対象とする場合、通常のDCFで使用される「時間」を基にした割引率以外に、新薬の臨床段階ごとの成功確率が割引率として考慮される。この場合、承認をいつ得ることができるかが最大のポイントとなるが、3つの開発品のうち、「SP-03」は国内販売が開始され、「SP-01」は2018年12月期上半期での承認を予定している同社の新薬開発に関する割引率は、他のバイオベンチャーよりも低く想定されてしかるべきであろう。
以上6点以外に中国市場での成長ポテンシャルの高さを挙げることができる。
世界のメガファーマも当然中国をはじめとしたアジア各国に拠点を設けているが、同社が開発の対象とするのは経営方針にあるように、大手製薬企業が業績重視の観点から着手しないがん領域や希少疾病領域での新規製品である。近年医薬品市場で注目を浴びるこうした製品はバイオベンチャー発のものであるが、大手は取り扱わないため、同社は、北京・上海・広州の自社販売網を含め、世界中のバイオベンチャーにとって急成長するアジア市場へのアクセスを提供できる貴重な存在となろう。加えて、中国ビジネスに強みを持ち筆頭株主である伊藤忠商事と香港、マカオを除く中国全土における販売代理店契約を締結し、そのネットワークを活用できる点も同社の大きなアドバンテージである。

 【1-2 企業理念・経営理念】
社名のソレイジア(SOLASIA)は、Sol(ラテン語で太陽)+Asia(アジア地域)からなるもので、「日本・アジアにおいて、
がんと向き合うさまざまな人たちの未来を照らす希望の太陽でありたい。」という想いを表している。
以下のような、『経営理念:ミッション、ビジョン、バリュー』を掲げている。
【1-2 企業理念・経営理念】
社名のソレイジア(SOLASIA)は、Sol(ラテン語で太陽)+Asia(アジア地域)からなるもので、「日本・アジアにおいて、
がんと向き合うさまざまな人たちの未来を照らす希望の太陽でありたい。」という想いを表している。
以下のような、『経営理念:ミッション、ビジョン、バリュー』を掲げている。
 また、経営方針として以下の2点を示している。
また、経営方針として以下の2点を示している。
 ニッチではあるが困っている患者が多数いるアンメット・メディカル・ニーズ(いまだに治療法が見つかっていない疾患に対する医療ニーズ)解決のための新薬開発に注力していく。
また、現在は研究開発が先行しているため財務CFに頼らざるを得ない現状であるが、早期に営業CF黒字化を実現し、持続的成長が可能な基盤を構築する。
【1-3 同社を取り巻く環境】
厚生労働省「平成27年(2015)人口動態統計」によれば、2015年の死因別順位は悪性新生物(がん)が、死亡数370,346人で全死亡者数1,290,444人の28.7%を占め第1位であった。
総人口の変化を加味した「死亡率(人口10万人に対し何人が死亡したか)」の推移を見ても、1981年に死亡率142.0人で、同134.3人の脳血管疾患に代わり第1位となって以来30年以上にわたり連続して第1位であり、その数値も年を追って上昇、2015年は295.5人となっている。
高齢化、また食生活を含めたライフスタイルの変化等によりがん発症率は上昇していると言われているが、中国においてもがんの発症者数及び死亡者数は増加傾向にある。
現在の国別医薬品市場規模は1位が米国で、中国が第2位だが、2020年には中国市場は米国市場と1位を分け合う規模まで拡大するとも言われている。
ニッチではあるが困っている患者が多数いるアンメット・メディカル・ニーズ(いまだに治療法が見つかっていない疾患に対する医療ニーズ)解決のための新薬開発に注力していく。
また、現在は研究開発が先行しているため財務CFに頼らざるを得ない現状であるが、早期に営業CF黒字化を実現し、持続的成長が可能な基盤を構築する。
【1-3 同社を取り巻く環境】
厚生労働省「平成27年(2015)人口動態統計」によれば、2015年の死因別順位は悪性新生物(がん)が、死亡数370,346人で全死亡者数1,290,444人の28.7%を占め第1位であった。
総人口の変化を加味した「死亡率(人口10万人に対し何人が死亡したか)」の推移を見ても、1981年に死亡率142.0人で、同134.3人の脳血管疾患に代わり第1位となって以来30年以上にわたり連続して第1位であり、その数値も年を追って上昇、2015年は295.5人となっている。
高齢化、また食生活を含めたライフスタイルの変化等によりがん発症率は上昇していると言われているが、中国においてもがんの発症者数及び死亡者数は増加傾向にある。
現在の国別医薬品市場規模は1位が米国で、中国が第2位だが、2020年には中国市場は米国市場と1位を分け合う規模まで拡大するとも言われている。
 こうしたがんによる死亡率の上昇に伴い、「新規抗がん剤」および「がんサポーティブケア」への期待が高まっている。
(新規抗がん剤)
抗がん剤を用いたがん治療においては、一つの抗がん剤のみを用いる単剤治療よりも、複数の抗がん剤を用いる併用療法のほうが主流である。
加えて、がんは種類によって異なるが、再発の可能性が高く、加えて難治の場合は、一種類の治療での治癒は困難であるため、一つの治療薬が絶対的な存在とはならず、他の治療薬が直接的な「競合」とはなり難いという特性がある。
また、近年では、分子標的薬や免疫療法が注目されてはいるが、まだ多くのがん種に対する治療において化学療法剤が重用されている。殺細胞性抗がん剤を含むレジメンは標準治療として位置づけられ、今後も高い医療ニーズが期待される。
(がんサポーティブケア)
抗がん剤はがん細胞を攻撃するなどの強力な医薬品であり副作用が避けられない。
患者に負担がかかる副作用をコントロールできなければ、抗がん剤の減量やがん治療そのものを中止せざるを得ず、結果的には病状が進行してしまうリスクがある。
こうした事態を避け、がん治療を完遂するためには、副作用のコントロールを行うための医薬品や医療機器への期待が高まっている。
また、がんの治療薬はがんの種類ごとに承認を得なければならないが、サポーティブケアはがんの種類を問わず、幅広いがん患者への処方が可能であり、大きなニーズ、市場が見込まれる。
以上のように、日本・中国におけるがん治療ニーズの増大とそれに対応した新規抗がん剤およびがんサポーティブケアへの期待は大きく、同社はこうしたニーズを取り込み、収益を拡大させるためのビジネスモデル、事業戦略を構築している。
【1-4 事業内容】
(1)ビジネスモデル
新しい医薬品が上市されるまでには、「基礎研究」から始まり、「製剤研究」、「非臨床開発(動物を用いて薬効薬理作用、生体内での動態、有害な作用などを調べる試験)」、「臨床開発(医薬品や治療技術などの人間への影響を調べる科学的試験)」を経て、当局の承認を得たのち、「製造」、「販売・マーケティング・製造販売後調査」といったプロセスを経るのが一般的である。
大手製薬会社は、巨額な研究開発費を変動費化することなどを目的にCROを利用した臨床開発段階のアウトソーシングを進めてはいるが、基本的には上記の工程全てを自社内に保有している。
これまではこうした体制が製薬会社の高収益体制を支えてきたが、近年の生命科学分野の急速な進歩や複雑化、多様化により、自社固有の創薬技術が陳腐化してしまう可能性が高まっている。
また、多額の費用と時間をかけて基礎研究から進めても臨床開発に入るまでに実用化を断念し、創薬技術を確立できないケースも多く、医薬品開発には常に高いリスクがついてまわる。
そこで同社では、失敗の確率の高い基礎研究から非臨床開発の工程を自社では行わず、まだ開発段階にある将来有望な医薬品を外部から導入して臨床開発から開発に着手。それ以降の事業活動に経営資源を集約することで自社の強みを発揮するとともにリスクの低減を図っている。
現時点ではコスト負担の大きい製造工程も保有しない計画である。
こうしたがんによる死亡率の上昇に伴い、「新規抗がん剤」および「がんサポーティブケア」への期待が高まっている。
(新規抗がん剤)
抗がん剤を用いたがん治療においては、一つの抗がん剤のみを用いる単剤治療よりも、複数の抗がん剤を用いる併用療法のほうが主流である。
加えて、がんは種類によって異なるが、再発の可能性が高く、加えて難治の場合は、一種類の治療での治癒は困難であるため、一つの治療薬が絶対的な存在とはならず、他の治療薬が直接的な「競合」とはなり難いという特性がある。
また、近年では、分子標的薬や免疫療法が注目されてはいるが、まだ多くのがん種に対する治療において化学療法剤が重用されている。殺細胞性抗がん剤を含むレジメンは標準治療として位置づけられ、今後も高い医療ニーズが期待される。
(がんサポーティブケア)
抗がん剤はがん細胞を攻撃するなどの強力な医薬品であり副作用が避けられない。
患者に負担がかかる副作用をコントロールできなければ、抗がん剤の減量やがん治療そのものを中止せざるを得ず、結果的には病状が進行してしまうリスクがある。
こうした事態を避け、がん治療を完遂するためには、副作用のコントロールを行うための医薬品や医療機器への期待が高まっている。
また、がんの治療薬はがんの種類ごとに承認を得なければならないが、サポーティブケアはがんの種類を問わず、幅広いがん患者への処方が可能であり、大きなニーズ、市場が見込まれる。
以上のように、日本・中国におけるがん治療ニーズの増大とそれに対応した新規抗がん剤およびがんサポーティブケアへの期待は大きく、同社はこうしたニーズを取り込み、収益を拡大させるためのビジネスモデル、事業戦略を構築している。
【1-4 事業内容】
(1)ビジネスモデル
新しい医薬品が上市されるまでには、「基礎研究」から始まり、「製剤研究」、「非臨床開発(動物を用いて薬効薬理作用、生体内での動態、有害な作用などを調べる試験)」、「臨床開発(医薬品や治療技術などの人間への影響を調べる科学的試験)」を経て、当局の承認を得たのち、「製造」、「販売・マーケティング・製造販売後調査」といったプロセスを経るのが一般的である。
大手製薬会社は、巨額な研究開発費を変動費化することなどを目的にCROを利用した臨床開発段階のアウトソーシングを進めてはいるが、基本的には上記の工程全てを自社内に保有している。
これまではこうした体制が製薬会社の高収益体制を支えてきたが、近年の生命科学分野の急速な進歩や複雑化、多様化により、自社固有の創薬技術が陳腐化してしまう可能性が高まっている。
また、多額の費用と時間をかけて基礎研究から進めても臨床開発に入るまでに実用化を断念し、創薬技術を確立できないケースも多く、医薬品開発には常に高いリスクがついてまわる。
そこで同社では、失敗の確率の高い基礎研究から非臨床開発の工程を自社では行わず、まだ開発段階にある将来有望な医薬品を外部から導入して臨床開発から開発に着手。それ以降の事業活動に経営資源を集約することで自社の強みを発揮するとともにリスクの低減を図っている。
現時点ではコスト負担の大きい製造工程も保有しない計画である。
 販売工程については、高収益確保とリスクコントロールのバランスを考慮した仕組みを構築している。
一般的に製薬企業の売上高総利益率は高水準であるが、これは、製造および販売活動を内製化することによって実現できると考えられる。
販売工程については、高収益確保とリスクコントロールのバランスを考慮した仕組みを構築している。
一般的に製薬企業の売上高総利益率は高水準であるが、これは、製造および販売活動を内製化することによって実現できると考えられる。
 一方医薬品は販売地域の網羅性(例:日本全国をカバー)が要求され、自社販売網を構築しようとすれば、固定費が増大する。
そこで同社では、臨床開発を終えた医薬品について、「自販モデル」と、販売権を他社に導出する「導出モデル」を併用している。
一方医薬品は販売地域の網羅性(例:日本全国をカバー)が要求され、自社販売網を構築しようとすれば、固定費が増大する。
そこで同社では、臨床開発を終えた医薬品について、「自販モデル」と、販売権を他社に導出する「導出モデル」を併用している。
 (自販モデル)
中国の3大都市「北京・上海・広州」においては自社販売体制を構築し自販モデルを展開する。
この3都市の人口合計は中国全人口の約5%に過ぎないが、抗がん剤を取り扱うのは最先端かつ大病院であるため、大病院が集中するこの3都市は中国の抗がん剤市場の3割を占める巨大マーケットである。
また、新しい医薬品の使用・普及にあたっては影響力のある医師の判断や決定がその結果を大きく左右する。こうした影響力のある医師の在籍する大病院への営業活動は極めて重要なポイントとなる。
加えて、中国全土ではなくあくまでもそれぞれの都市における営業であり、少人数の販売組織でも十分に活動は可能である。現在約50-60の大病院を対象とした営業スタッフ増強に動いている。
(自販モデル)
中国の3大都市「北京・上海・広州」においては自社販売体制を構築し自販モデルを展開する。
この3都市の人口合計は中国全人口の約5%に過ぎないが、抗がん剤を取り扱うのは最先端かつ大病院であるため、大病院が集中するこの3都市は中国の抗がん剤市場の3割を占める巨大マーケットである。
また、新しい医薬品の使用・普及にあたっては影響力のある医師の判断や決定がその結果を大きく左右する。こうした影響力のある医師の在籍する大病院への営業活動は極めて重要なポイントとなる。
加えて、中国全土ではなくあくまでもそれぞれの都市における営業であり、少人数の販売組織でも十分に活動は可能である。現在約50-60の大病院を対象とした営業スタッフ増強に動いている。
 今後も共同歩調が取りやすくWIN-WINの関係を構築できる中堅製薬メーカーを中心に導出先パートナーとして確保していく考えだ。
(2)開発パイプライン
現在、前述の経営方針に沿って以下4つの開発パイプラインを有している。
今後も共同歩調が取りやすくWIN-WINの関係を構築できる中堅製薬メーカーを中心に導出先パートナーとして確保していく考えだ。
(2)開発パイプライン
現在、前述の経営方針に沿って以下4つの開発パイプラインを有している。
 (対象疾病の概要)
抗がん剤の代表的な副作用として悪心や嘔吐はよく知られている。
抗がん剤を投与すると、小腸にあるクロム親和性細胞と呼ばれる細胞がダメージを受ける。
ダメージを受けたクロム親和性細胞はセロトニンという神経伝達物質を放出。これが末梢の迷走神経上にある5-HT3受容体に取りこまれ、その刺激が末梢の迷走神経に沿って、脳の第4脳室最後野にある化学受容器引金帯(CTZ)を介して延髄に入り、悪心・嘔吐の命令を生体に出す嘔吐中枢を刺激し、悪心や嘔吐が発現する。
悪心・嘔吐を抑制するためにはセロトニンによる5-HT3受容体への刺激を遮断することが必要であり、そのために用いられる薬剤「5-HT3受容体拮抗薬」としては様々なものがあるが、代表的な薬剤がグラニセトロンである。
(「SP-01」概要)
「SP-01」は、このグラニセトロンを含んだ5-HT3受容体拮抗薬の経皮吸収型製剤(貼付剤)で、貼り薬としては世界唯一。
(対象疾病の概要)
抗がん剤の代表的な副作用として悪心や嘔吐はよく知られている。
抗がん剤を投与すると、小腸にあるクロム親和性細胞と呼ばれる細胞がダメージを受ける。
ダメージを受けたクロム親和性細胞はセロトニンという神経伝達物質を放出。これが末梢の迷走神経上にある5-HT3受容体に取りこまれ、その刺激が末梢の迷走神経に沿って、脳の第4脳室最後野にある化学受容器引金帯(CTZ)を介して延髄に入り、悪心・嘔吐の命令を生体に出す嘔吐中枢を刺激し、悪心や嘔吐が発現する。
悪心・嘔吐を抑制するためにはセロトニンによる5-HT3受容体への刺激を遮断することが必要であり、そのために用いられる薬剤「5-HT3受容体拮抗薬」としては様々なものがあるが、代表的な薬剤がグラニセトロンである。
(「SP-01」概要)
「SP-01」は、このグラニセトロンを含んだ5-HT3受容体拮抗薬の経皮吸収型製剤(貼付剤)で、貼り薬としては世界唯一。
 抗がん剤は5日間にわたり投与するケースが多いが、注射や経口による制吐剤は概ね1~2日間しか効果がなく、抗がん剤投与期間内に複数回注射しなければならない。
これに対し「SP-01」は5日間にわたって安定的に血中のグラニセトロン濃度を維持することができるため、1回貼り付ければ制吐剤を追加する必要がなく、入院ではなく外来によるがん治療を可能とするため、患者のQOL向上にも大きく貢献する。
悪心・嘔吐、口内炎などが原因で、薬剤の服用が困難な状態にある場合でも、経皮吸収型製剤は使用可能である点も大きなメリットであり、以上のような点を評価され、米国NCCN診療ガイドライン、中国治療ガイドラインで処方推奨を得ている。
(開発および販売状況)
現在上市済の地域は、米国、英国、ドイツ、イタリア、オランダ、デンマーク、フィンランド、ノルウェー、スウェーデン、クウェート、レバノン、カタール、バーレーン、アラブ首長国連邦、サウジアラビア、韓国、フィリピン、(以上、導入元等が販売)、台湾、香港、シンガポール、マカオ(以上、同社サブライセンス先の協和発酵キリンが販売)など多数にわたっている。今後は、がん化学療法だけでなく放射線療法による悪心・嘔吐抑制への適応拡大を見込んでいる。中国での承認申請は2014年6月に完了し現在は承認審査中。2018年上半期(1~6月)での承認、その後の販売開始を見込んでいる。
抗がん剤は5日間にわたり投与するケースが多いが、注射や経口による制吐剤は概ね1~2日間しか効果がなく、抗がん剤投与期間内に複数回注射しなければならない。
これに対し「SP-01」は5日間にわたって安定的に血中のグラニセトロン濃度を維持することができるため、1回貼り付ければ制吐剤を追加する必要がなく、入院ではなく外来によるがん治療を可能とするため、患者のQOL向上にも大きく貢献する。
悪心・嘔吐、口内炎などが原因で、薬剤の服用が困難な状態にある場合でも、経皮吸収型製剤は使用可能である点も大きなメリットであり、以上のような点を評価され、米国NCCN診療ガイドライン、中国治療ガイドラインで処方推奨を得ている。
(開発および販売状況)
現在上市済の地域は、米国、英国、ドイツ、イタリア、オランダ、デンマーク、フィンランド、ノルウェー、スウェーデン、クウェート、レバノン、カタール、バーレーン、アラブ首長国連邦、サウジアラビア、韓国、フィリピン、(以上、導入元等が販売)、台湾、香港、シンガポール、マカオ(以上、同社サブライセンス先の協和発酵キリンが販売)など多数にわたっている。今後は、がん化学療法だけでなく放射線療法による悪心・嘔吐抑制への適応拡大を見込んでいる。中国での承認申請は2014年6月に完了し現在は承認審査中。2018年上半期(1~6月)での承認、その後の販売開始を見込んでいる。
 (対象疾病の概要)
悪性リンパ腫は、血液がんの1つで、白血球の中のリンパ球ががん化したもの。
リンパ球には、B細胞、T細胞、NK細胞等の種類があり、これらががん化して無制限に増殖することで発症する。
末梢性T細胞リンパ腫(PTCL:Peripheral T-cell lymphoma)とは、悪性リンパ腫の種類の1つ。リンパ球の中のT細胞から発生するもので、月単位で病気が進行する「中悪性度」に分類され、中悪性度リンパ腫の10~15%を占めるといわれている。
B細胞リンパ腫などに比べ、5年生存率は低く、25%前後である。
(開発および販売状況)
「SP-02」は、この末梢性T細胞リンパ腫(PTCL)への適応で開発をスタートさせた。
2015年10月までに米国や日本、韓国等にて187名の被験者に投与される実績を有する。
米国における前期第Ⅱ相臨床試験は2012年4月に完了し、白人種における一定の有効性を確認した。
2015年4月に完了した日本および韓国における第Ⅰ相臨床試験では、PTCL患者において安全性及び忍容性が確認され、アジア人種における一定の有効性が示唆された。
2016年にスタートした日本、韓国、台湾、香港での最終試験として位置づけられる第Ⅱ相国際共同臨床試験が進行中で、2018年末までに終了の予定。中国においては最終試験である第Ⅱ/Ⅲ相臨床試験の準備中である。
悪性リンパ腫はしばしば再発することが知られており、作用機序の異なる複数の治療薬が必要でマーケットは大きいと同社は考えている。
末梢性T細胞リンパ腫のみでなく、その他血液がん(リンパ腫、白血病)や固形がんへの適応拡大を目指しており、2019年以降の開発開始を予定している。
日本での開発販売権はMeiji Seika ファルマ株式会社に導出済で、欧米及び中国では導出先を選定中である。
(対象疾病の概要)
悪性リンパ腫は、血液がんの1つで、白血球の中のリンパ球ががん化したもの。
リンパ球には、B細胞、T細胞、NK細胞等の種類があり、これらががん化して無制限に増殖することで発症する。
末梢性T細胞リンパ腫(PTCL:Peripheral T-cell lymphoma)とは、悪性リンパ腫の種類の1つ。リンパ球の中のT細胞から発生するもので、月単位で病気が進行する「中悪性度」に分類され、中悪性度リンパ腫の10~15%を占めるといわれている。
B細胞リンパ腫などに比べ、5年生存率は低く、25%前後である。
(開発および販売状況)
「SP-02」は、この末梢性T細胞リンパ腫(PTCL)への適応で開発をスタートさせた。
2015年10月までに米国や日本、韓国等にて187名の被験者に投与される実績を有する。
米国における前期第Ⅱ相臨床試験は2012年4月に完了し、白人種における一定の有効性を確認した。
2015年4月に完了した日本および韓国における第Ⅰ相臨床試験では、PTCL患者において安全性及び忍容性が確認され、アジア人種における一定の有効性が示唆された。
2016年にスタートした日本、韓国、台湾、香港での最終試験として位置づけられる第Ⅱ相国際共同臨床試験が進行中で、2018年末までに終了の予定。中国においては最終試験である第Ⅱ/Ⅲ相臨床試験の準備中である。
悪性リンパ腫はしばしば再発することが知られており、作用機序の異なる複数の治療薬が必要でマーケットは大きいと同社は考えている。
末梢性T細胞リンパ腫のみでなく、その他血液がん(リンパ腫、白血病)や固形がんへの適応拡大を目指しており、2019年以降の開発開始を予定している。
日本での開発販売権はMeiji Seika ファルマ株式会社に導出済で、欧米及び中国では導出先を選定中である。
 (対象疾病の概要)
抗がん剤による悪心・嘔吐と並んで、癌化学療法又は放射線療法による口腔粘膜障害の副作用も患者にとっては大きな困難である。
口内炎は、「化学療法が口腔粘膜へ直接作用して障害が生じるもの」や「放射線照射により唾液腺組織に障害が生じ、唾液の分泌低下により口腔内の自浄作用が低下し局所感染が起こることで発生するもの」である一次口内炎と、「白血球減少などに伴う骨髄抑制により起こる口腔内感染が原因となるもの」である二次口内炎がある。
抗がん剤治療に伴う口内炎の発生頻度は30~40%、抗がん剤と頭頸部への放射線治療併用時の口内炎発生頻度は約100%となっている。
癌化学療法又は放射線療法による口内炎は、300~500もの多数の炎症が発生する。その疼痛により患者は食事や水分の経口摂取が困難になり体力低下を招き、重症化すると本来のがん治療の継続にも悪影響を及ぼしてしまう。
ただ、現在のところ標準的な対処法はなく、各病院ごとでの対症療法に頼っているのが現状である。
(「SP-03」概要)
「SP-03」は、脂質ベースの液体を口腔粘膜に滴下塗布するものであり、同社ではカテゴリーとしては医療機器として開発を進めてきた。
(対象疾病の概要)
抗がん剤による悪心・嘔吐と並んで、癌化学療法又は放射線療法による口腔粘膜障害の副作用も患者にとっては大きな困難である。
口内炎は、「化学療法が口腔粘膜へ直接作用して障害が生じるもの」や「放射線照射により唾液腺組織に障害が生じ、唾液の分泌低下により口腔内の自浄作用が低下し局所感染が起こることで発生するもの」である一次口内炎と、「白血球減少などに伴う骨髄抑制により起こる口腔内感染が原因となるもの」である二次口内炎がある。
抗がん剤治療に伴う口内炎の発生頻度は30~40%、抗がん剤と頭頸部への放射線治療併用時の口内炎発生頻度は約100%となっている。
癌化学療法又は放射線療法による口内炎は、300~500もの多数の炎症が発生する。その疼痛により患者は食事や水分の経口摂取が困難になり体力低下を招き、重症化すると本来のがん治療の継続にも悪影響を及ぼしてしまう。
ただ、現在のところ標準的な対処法はなく、各病院ごとでの対症療法に頼っているのが現状である。
(「SP-03」概要)
「SP-03」は、脂質ベースの液体を口腔粘膜に滴下塗布するものであり、同社ではカテゴリーとしては医療機器として開発を進めてきた。
 口腔粘膜に適量を適用すると、数分以内に液体が口腔内の水分を吸収し生体接着ゲル化し、物理的なバリヤーを形成するもので、8時間程度の口内炎の疼痛緩和効果が臨床的に示されている。
2016年に日本における承認申請を完了していたが、2017年7月6日付けで、厚生労働省より、日本国内における医療機器製造販売承認を取得した。2018年1月には第388回中央社会保険医療協議会総会において18年4月からの保険適用が承認され、保険収載を経て、18年5月、日本における独占販売権の導出先であるMeiji Seika ファルマ株式会社による販売が開始された。なお、中国においても2016年5月に医療機器製造販売承認申請を当局に行っており、2018年中の承認、その後の販売開始を計画している。
北京、上海、広州では自社販売を、その他の中国地域についてはLee’s Pharma社へ販売権を導出している。
日本以外では、米国、英国、ドイツ、デンマーク、ノルウェー、スウェーデン、フランスなどで他社及び導入元により販売されている。
口腔粘膜に適量を適用すると、数分以内に液体が口腔内の水分を吸収し生体接着ゲル化し、物理的なバリヤーを形成するもので、8時間程度の口内炎の疼痛緩和効果が臨床的に示されている。
2016年に日本における承認申請を完了していたが、2017年7月6日付けで、厚生労働省より、日本国内における医療機器製造販売承認を取得した。2018年1月には第388回中央社会保険医療協議会総会において18年4月からの保険適用が承認され、保険収載を経て、18年5月、日本における独占販売権の導出先であるMeiji Seika ファルマ株式会社による販売が開始された。なお、中国においても2016年5月に医療機器製造販売承認申請を当局に行っており、2018年中の承認、その後の販売開始を計画している。
北京、上海、広州では自社販売を、その他の中国地域についてはLee’s Pharma社へ販売権を導出している。
日本以外では、米国、英国、ドイツ、デンマーク、ノルウェー、スウェーデン、フランスなどで他社及び導入元により販売されている。
 先行する3つの開発がおおむね順調に進む中、4つ目のパイプライン導入を上場時から検討していた同社は、「がん領域である。」、「臨床試験が一定程度進んでいる。」、「日本及び中国での開発権利を獲得できる。」という3つの条件を満たす新薬を探していた。そして、2017年11月にスウェーデンのPledPharma AB(以下、「Pled 社」)から、がん化学療法に伴う末梢神経障害薬「PledOx®」の日本、中国、韓国、台湾、香港及びマカオでの開発事業化の独占的権利を獲得した。早期の承認取得を実現するため、まず大腸がん治療における代表的な抗がん剤「オキサリプラチン」投与による末梢神経障害に適応を絞り、日本や中国など東アジア地域での臨床開発を進めていく。
(対象疾病の概要)
がん化学療法は、悪心・嘔吐や口内炎発症等の副作用が生じるが、末梢神経障害も重篤な副作用の一つ。
末梢神経障害は、プラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤において、顕著に発現することが知られている。
大腸がんのうち手術による治癒が難しい進行・再発がん(ステージⅢ、Ⅳ)に対する化学療法及び術後補助化学療法における代表的な治療法であるFOLFOX療法は、フルオロウラシル・フォリン酸・オキサリプラチンの 3 剤を併用するものだが、このうちオキサリプラチンの処方は、患者の約9割で「手、足や口唇周囲部等の異常感覚」、「呼吸困難や嚥下障害を伴う咽頭喉頭の絞扼感(しめつけ)」、「手足先のしびれ」、「感覚低下」、「感覚性運動失調」などの症状を伴う末梢神経障害を生じさせる。
このような副作用が発現した場合には、薬剤中止により、80%の症例では一部症状の改善がみられ、40%の症例では 6~8 ヶ月後には完全に回復するが、薬剤中止はがん化学療法の中止や方針変更となる可能性があり、末梢神経障害の治療は医療上の重要な課題である。
ただ、がん化学療法の副作用としての末梢神経障害を適応として当局に承認された医薬品は現時点では存在していない。
(「SP-04」概要)
「SP-04:PledOx®」の導入元Pled 社はストックホルム証券取引所に上場しており、酸化ストレス関連の疾患に対する医薬品開発に強みを持つ。
「PledOx®」(一般名:Calmangafodipir)は欧米で販売実績を有するMRI造影剤「Mangafodipir」を基に創生された新有効成分である。
後述のように「SP-04:PledOx®」は後期第Ⅱ相臨床試験を終了し、今後、第Ⅲ相国際共同臨床試験が開始される予定で、末梢神経障害薬のトップランナー。開発成功は大きな先行者利益獲得につながるだけでなく、がん患者のQOL向上など社会的貢献度も高い。
*市場性
ソレイジア・ファーマによれば、FOLFOX療法の対象となる大腸がん患者数は年間で日本6~10万人、中国20万人程度と推定している。
FOLFOX療法は、「3日間の治療、11日間の休薬期間」の計14日間が1サイクルであり、それを12サイクル行う治療法である。
対象疾患はオキサリプラチン投与を含むがん化学療法の対象となる大腸がんであるが、オキサリプラチン以外のプラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤においても末梢神経障害が顕著に発現することがしられており、乳がん、肺がん、卵巣がん、膵臓がんなど大腸がん以外の固形がんも追加対象疾患となれば、市場性は更に広がると同社は想定している。
*開発状況
Pled 社は、これまで末梢神経障害を適応として PledOx®の研究開発を欧米で行ってきており、後期第Ⅱ相臨床試験までの結果、FOLFOX療法を受けている進行性大腸がん患者において、有効性と安全性、つまり末梢神経障害を改善する効果およびFOLFOX 療法によるがん治療そのものへの影響を生じさせないこと等についての効果が示唆されている。Pled 社は、日本への導出を検討した際、日本人を対象とした臨床試験が必要と判断したため米国で日本人を被験者とするPledOx®の第Ⅰ相臨床試験を実施してきたが、18年2月、この第Ⅰ相臨床試験は終了し、SP-04の日本人における良好な安全性及び忍容性が確認された。
Pled 社は、FDA(米国食品医薬品局)及び EMA(欧州医薬品庁)との協議を経た第Ⅲ相国際共同臨床試験への被験者登録を2018年下半期(7-12月)に開始する予定であると発表している。
日本人を被験者とする第Ⅰ相臨床試験が終了したソレイジア・ファーマは日本当局と協議の上、この第Ⅲ相国際共同臨床試験に参画したいと考えていたが、2018年6月、PMDA(独立行政法人医薬品医療機器総合機構)との協議を経て、ソレイジア・ファーマの権利地域である日本等(日本・韓国・台湾・香港)の参画を決定した。
試験の概要は以下の通り。
先行する3つの開発がおおむね順調に進む中、4つ目のパイプライン導入を上場時から検討していた同社は、「がん領域である。」、「臨床試験が一定程度進んでいる。」、「日本及び中国での開発権利を獲得できる。」という3つの条件を満たす新薬を探していた。そして、2017年11月にスウェーデンのPledPharma AB(以下、「Pled 社」)から、がん化学療法に伴う末梢神経障害薬「PledOx®」の日本、中国、韓国、台湾、香港及びマカオでの開発事業化の独占的権利を獲得した。早期の承認取得を実現するため、まず大腸がん治療における代表的な抗がん剤「オキサリプラチン」投与による末梢神経障害に適応を絞り、日本や中国など東アジア地域での臨床開発を進めていく。
(対象疾病の概要)
がん化学療法は、悪心・嘔吐や口内炎発症等の副作用が生じるが、末梢神経障害も重篤な副作用の一つ。
末梢神経障害は、プラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤において、顕著に発現することが知られている。
大腸がんのうち手術による治癒が難しい進行・再発がん(ステージⅢ、Ⅳ)に対する化学療法及び術後補助化学療法における代表的な治療法であるFOLFOX療法は、フルオロウラシル・フォリン酸・オキサリプラチンの 3 剤を併用するものだが、このうちオキサリプラチンの処方は、患者の約9割で「手、足や口唇周囲部等の異常感覚」、「呼吸困難や嚥下障害を伴う咽頭喉頭の絞扼感(しめつけ)」、「手足先のしびれ」、「感覚低下」、「感覚性運動失調」などの症状を伴う末梢神経障害を生じさせる。
このような副作用が発現した場合には、薬剤中止により、80%の症例では一部症状の改善がみられ、40%の症例では 6~8 ヶ月後には完全に回復するが、薬剤中止はがん化学療法の中止や方針変更となる可能性があり、末梢神経障害の治療は医療上の重要な課題である。
ただ、がん化学療法の副作用としての末梢神経障害を適応として当局に承認された医薬品は現時点では存在していない。
(「SP-04」概要)
「SP-04:PledOx®」の導入元Pled 社はストックホルム証券取引所に上場しており、酸化ストレス関連の疾患に対する医薬品開発に強みを持つ。
「PledOx®」(一般名:Calmangafodipir)は欧米で販売実績を有するMRI造影剤「Mangafodipir」を基に創生された新有効成分である。
後述のように「SP-04:PledOx®」は後期第Ⅱ相臨床試験を終了し、今後、第Ⅲ相国際共同臨床試験が開始される予定で、末梢神経障害薬のトップランナー。開発成功は大きな先行者利益獲得につながるだけでなく、がん患者のQOL向上など社会的貢献度も高い。
*市場性
ソレイジア・ファーマによれば、FOLFOX療法の対象となる大腸がん患者数は年間で日本6~10万人、中国20万人程度と推定している。
FOLFOX療法は、「3日間の治療、11日間の休薬期間」の計14日間が1サイクルであり、それを12サイクル行う治療法である。
対象疾患はオキサリプラチン投与を含むがん化学療法の対象となる大腸がんであるが、オキサリプラチン以外のプラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤においても末梢神経障害が顕著に発現することがしられており、乳がん、肺がん、卵巣がん、膵臓がんなど大腸がん以外の固形がんも追加対象疾患となれば、市場性は更に広がると同社は想定している。
*開発状況
Pled 社は、これまで末梢神経障害を適応として PledOx®の研究開発を欧米で行ってきており、後期第Ⅱ相臨床試験までの結果、FOLFOX療法を受けている進行性大腸がん患者において、有効性と安全性、つまり末梢神経障害を改善する効果およびFOLFOX 療法によるがん治療そのものへの影響を生じさせないこと等についての効果が示唆されている。Pled 社は、日本への導出を検討した際、日本人を対象とした臨床試験が必要と判断したため米国で日本人を被験者とするPledOx®の第Ⅰ相臨床試験を実施してきたが、18年2月、この第Ⅰ相臨床試験は終了し、SP-04の日本人における良好な安全性及び忍容性が確認された。
Pled 社は、FDA(米国食品医薬品局)及び EMA(欧州医薬品庁)との協議を経た第Ⅲ相国際共同臨床試験への被験者登録を2018年下半期(7-12月)に開始する予定であると発表している。
日本人を被験者とする第Ⅰ相臨床試験が終了したソレイジア・ファーマは日本当局と協議の上、この第Ⅲ相国際共同臨床試験に参画したいと考えていたが、2018年6月、PMDA(独立行政法人医薬品医療機器総合機構)との協議を経て、ソレイジア・ファーマの権利地域である日本等(日本・韓国・台湾・香港)の参画を決定した。
試験の概要は以下の通り。
 ※プラセボ対照試験
薬の臨床試験において、被験者を対照群と治療群とに分け、対照群にはプラセボを割り付ける試験。 プラセボとは色、重さ、味及び匂いなどを可能な限り被験薬に似せ、かつ薬効成分を含まない「偽薬」。
第Ⅲ相国際共同臨床試験への参画が決定されたことで、「SP-04」の事業化はソレイジア・ファーマ単独で臨床試験を実施する場合、第Ⅲ相臨床試験に先立ち第Ⅱ相臨床試験を実施する場合と比べ、時間、費用とも大幅に短縮、抑制されることが見込まれる。
以上4つのパイプラインの開発・事業化の経緯、現状、今後の計画は以下のとおりである。
※プラセボ対照試験
薬の臨床試験において、被験者を対照群と治療群とに分け、対照群にはプラセボを割り付ける試験。 プラセボとは色、重さ、味及び匂いなどを可能な限り被験薬に似せ、かつ薬効成分を含まない「偽薬」。
第Ⅲ相国際共同臨床試験への参画が決定されたことで、「SP-04」の事業化はソレイジア・ファーマ単独で臨床試験を実施する場合、第Ⅲ相臨床試験に先立ち第Ⅱ相臨床試験を実施する場合と比べ、時間、費用とも大幅に短縮、抑制されることが見込まれる。
以上4つのパイプラインの開発・事業化の経緯、現状、今後の計画は以下のとおりである。
 【1-5 バイオベンチャーとしての6つの特徴】
バイオベンチャーとしての同社を特徴づけるのは主に以下の6点である。
①創業の経緯
同社のスタートは、伊藤忠商事と米国のバイオに特化したVCであるMPMキャピタルによって設立された「JapanBridge (Ireland) Limited」。数社のバイオベンチャーから新薬の権利を導入し、開発を進めた。
当初はExitとして製薬会社への売却を中心に考えていたが、4-5年ほど前からは事業の将来性、有望性から企業として永続的に事業を展開する方向にシフトし、研究開発に向けた資金調達も必要なため株式公開の道を選択した。
もともと他社への売却を念頭に置いていたことから、保有する開発品は開発段階ではあっても他社に売却して現金化可能な優良な資産で構成されており、創業時より既に強固な事業基盤を構築している。
②実務経験豊富な臨床開発陣
研究部門や前臨床部門を持たず、新薬開発の権利導入を活用し、臨床開発以降の医薬品創造プロセスに特化している。医薬品事業化への研究開発過程において最も大切なのは最終的に当局の承認を取得することであるが、そのためには臨床開発、特に第Ⅱ相以降の後期臨床段階におけるスキルやノウハウが最も重要である。
数多い日本のバイオベンチャーの中でも、社長が臨床開発をコアスキルとして身に付け、強力な武器としているのは同社荒井社長以外には見当たらない。
荒井社長率いる実務経験豊富な臨床開発スタッフは同社の強力な差別化要因、競争優位性である。
③開発成功確率の高さ
直近導入した「SP-04」に先立ち、「SP-01」、「SP-02」、「SP-03」という3つの開発品を導入しているが、開発中止や失敗実績はなく、3つの開発品全てが事業化に至る最終段階(1つは日本で販売開始、1つは承認申請済、1つは最終臨床試験実施中)にある。
この高い開発成功確率を可能にしているのは2つの要因である。
1つ目は、失敗のリスクの低いものを選定し導入するビジネスモデル。
2つ目は、臨床開発のすべてを担うことのできるチームが社内にあること。前述のように、承認を取るためには何が必要かを熟知した開発陣は、導入品が承認をとれるか否かについてのスクリーニングをかけることができる。
1つ目、2つ目を合わせた、いわば「目利き力」が、開発断念に至るリスクを引き下げ、3打数3安打という高打率の源泉となっている。
新薬のキャッシュインフローをDCF(ディスカウント・キャッシュフロー)モデルから分析してみると、将来にわたるトータルのキャッシュインフローの大部分を構成するのは契約金やマイルストンではなくロイヤルティであるが、言うまでもなくロイヤリティは最終的に開発が成功し、販売が拡大しないと獲得することはできない
Pled社への提案に際し、多くの競合に比べ、契約金を始めとした金額面では決して有利ではなかったにもかかわらず今回「SP-04」を導入できたのも、明確な臨床開発設計を構築できるチーム力、先行3製品の開発実績、日本・中国を含めたアジアでの実績などをPled社が評価し、ソレイジア・ファーマがアジアにおける「PledOx®」成功のためのベストパートナーと判断したものであろう。
④安定した事業基盤
前述のように開発品3つ全てにおいて、製薬企業への販売権導出を達成しており、自社販売と組み合わせたリスクヘッジのためのポートフォリオを構築済である。
⑤高利益確保のための自販体制
製薬会社が高い収益性を実現できているのは、自社で製造・販売双方を手掛けているためだ。
同社は現在のところ製造設備は保有していないが、収益性を高めるためにマーケットが大きくかつ効率的に営業活動が展開できる中国の三大都市(北京、上海、広州)に自社販売体制を構築中である。
⑥事業の早期実現
バイオベンチャーの場合、新薬開発段階では損失を計上しているのが一般的であるため、株価や事業価値の算定において損益計算書を使用することは合理的ではなく、DCFモデルを使用することとなるが、バイオベンチャーを対象とする場合、通常のDCFで使用される「時間」を基にした割引率以外に、新薬の臨床段階ごとの成功確率が割引率として考慮される。この場合、承認をいつ得ることができるかが最大のポイントとなるが、3つの開発品のうち、「SP-03」は国内販売が開始され、「SP-01」は2018年12月期上半期での承認を予定している同社の新薬開発に関する割引率は、他のバイオベンチャーよりも低く想定されてしかるべきであろう。
以上6点以外に中国市場での成長ポテンシャルの高さを挙げることができる。
世界のメガファーマも当然中国をはじめとしたアジア各国に拠点を設けているが、同社が開発の対象とするのは経営方針にあるように、大手製薬企業が業績重視の観点から着手しないがん領域や希少疾病領域での新規製品である。近年医薬品市場で注目を浴びるこうした製品はバイオベンチャー発のものであるが、大手は取り扱わないため、同社は、北京・上海・広州の自社販売網を含め、世界中のバイオベンチャーにとって急成長するアジア市場へのアクセスを提供できる貴重な存在となろう。加えて、中国ビジネスに強みを持ち筆頭株主である伊藤忠商事と香港、マカオを除く中国全土における販売代理店契約を締結し、そのネットワークを活用できる点も同社の大きなアドバンテージである。
【1-5 バイオベンチャーとしての6つの特徴】
バイオベンチャーとしての同社を特徴づけるのは主に以下の6点である。
①創業の経緯
同社のスタートは、伊藤忠商事と米国のバイオに特化したVCであるMPMキャピタルによって設立された「JapanBridge (Ireland) Limited」。数社のバイオベンチャーから新薬の権利を導入し、開発を進めた。
当初はExitとして製薬会社への売却を中心に考えていたが、4-5年ほど前からは事業の将来性、有望性から企業として永続的に事業を展開する方向にシフトし、研究開発に向けた資金調達も必要なため株式公開の道を選択した。
もともと他社への売却を念頭に置いていたことから、保有する開発品は開発段階ではあっても他社に売却して現金化可能な優良な資産で構成されており、創業時より既に強固な事業基盤を構築している。
②実務経験豊富な臨床開発陣
研究部門や前臨床部門を持たず、新薬開発の権利導入を活用し、臨床開発以降の医薬品創造プロセスに特化している。医薬品事業化への研究開発過程において最も大切なのは最終的に当局の承認を取得することであるが、そのためには臨床開発、特に第Ⅱ相以降の後期臨床段階におけるスキルやノウハウが最も重要である。
数多い日本のバイオベンチャーの中でも、社長が臨床開発をコアスキルとして身に付け、強力な武器としているのは同社荒井社長以外には見当たらない。
荒井社長率いる実務経験豊富な臨床開発スタッフは同社の強力な差別化要因、競争優位性である。
③開発成功確率の高さ
直近導入した「SP-04」に先立ち、「SP-01」、「SP-02」、「SP-03」という3つの開発品を導入しているが、開発中止や失敗実績はなく、3つの開発品全てが事業化に至る最終段階(1つは日本で販売開始、1つは承認申請済、1つは最終臨床試験実施中)にある。
この高い開発成功確率を可能にしているのは2つの要因である。
1つ目は、失敗のリスクの低いものを選定し導入するビジネスモデル。
2つ目は、臨床開発のすべてを担うことのできるチームが社内にあること。前述のように、承認を取るためには何が必要かを熟知した開発陣は、導入品が承認をとれるか否かについてのスクリーニングをかけることができる。
1つ目、2つ目を合わせた、いわば「目利き力」が、開発断念に至るリスクを引き下げ、3打数3安打という高打率の源泉となっている。
新薬のキャッシュインフローをDCF(ディスカウント・キャッシュフロー)モデルから分析してみると、将来にわたるトータルのキャッシュインフローの大部分を構成するのは契約金やマイルストンではなくロイヤルティであるが、言うまでもなくロイヤリティは最終的に開発が成功し、販売が拡大しないと獲得することはできない
Pled社への提案に際し、多くの競合に比べ、契約金を始めとした金額面では決して有利ではなかったにもかかわらず今回「SP-04」を導入できたのも、明確な臨床開発設計を構築できるチーム力、先行3製品の開発実績、日本・中国を含めたアジアでの実績などをPled社が評価し、ソレイジア・ファーマがアジアにおける「PledOx®」成功のためのベストパートナーと判断したものであろう。
④安定した事業基盤
前述のように開発品3つ全てにおいて、製薬企業への販売権導出を達成しており、自社販売と組み合わせたリスクヘッジのためのポートフォリオを構築済である。
⑤高利益確保のための自販体制
製薬会社が高い収益性を実現できているのは、自社で製造・販売双方を手掛けているためだ。
同社は現在のところ製造設備は保有していないが、収益性を高めるためにマーケットが大きくかつ効率的に営業活動が展開できる中国の三大都市(北京、上海、広州)に自社販売体制を構築中である。
⑥事業の早期実現
バイオベンチャーの場合、新薬開発段階では損失を計上しているのが一般的であるため、株価や事業価値の算定において損益計算書を使用することは合理的ではなく、DCFモデルを使用することとなるが、バイオベンチャーを対象とする場合、通常のDCFで使用される「時間」を基にした割引率以外に、新薬の臨床段階ごとの成功確率が割引率として考慮される。この場合、承認をいつ得ることができるかが最大のポイントとなるが、3つの開発品のうち、「SP-03」は国内販売が開始され、「SP-01」は2018年12月期上半期での承認を予定している同社の新薬開発に関する割引率は、他のバイオベンチャーよりも低く想定されてしかるべきであろう。
以上6点以外に中国市場での成長ポテンシャルの高さを挙げることができる。
世界のメガファーマも当然中国をはじめとしたアジア各国に拠点を設けているが、同社が開発の対象とするのは経営方針にあるように、大手製薬企業が業績重視の観点から着手しないがん領域や希少疾病領域での新規製品である。近年医薬品市場で注目を浴びるこうした製品はバイオベンチャー発のものであるが、大手は取り扱わないため、同社は、北京・上海・広州の自社販売網を含め、世界中のバイオベンチャーにとって急成長するアジア市場へのアクセスを提供できる貴重な存在となろう。加えて、中国ビジネスに強みを持ち筆頭株主である伊藤忠商事と香港、マカオを除く中国全土における販売代理店契約を締結し、そのネットワークを活用できる点も同社の大きなアドバンテージである。
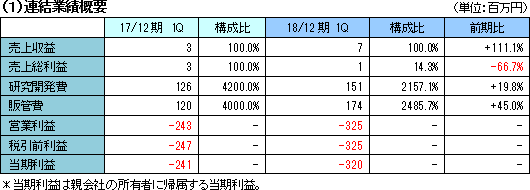 売上収益は7百万円。内容は、開発品SP-03の日本での販売準備等に供されるサンプル製品販売など。
パイプラインの開発強化を目的とする開発投資のうち研究開発費151百万円、主に開発と事業化を推進するための体制整備に投下した販管費174百万円により営業損失は3億25百万円。
売上収益は7百万円。内容は、開発品SP-03の日本での販売準備等に供されるサンプル製品販売など。
パイプラインの開発強化を目的とする開発投資のうち研究開発費151百万円、主に開発と事業化を推進するための体制整備に投下した販管費174百万円により営業損失は3億25百万円。
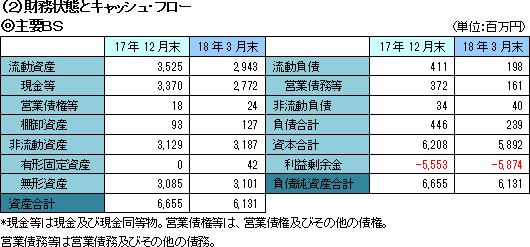 資産合計は前期末に比べ5億24百万円減少し、61億31百万円。自己資本比率(親会社所有者帰属持分比率)は96.1%。
資産合計は前期末に比べ5億24百万円減少し、61億31百万円。自己資本比率(親会社所有者帰属持分比率)は96.1%。
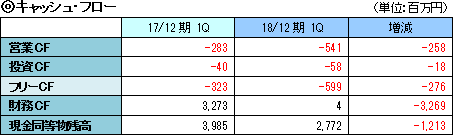 前年同期にあった新株発行による収入がなく、キャッシュポジションは前年同期に比べ12億円低下した。
(3)トピックス
◎「継続企業の前提に関する重要事象等」の記載を解消
2018年5月15日、「2018年12月期 第1四半期決算短信」において、「継続企業の前提に関する重要事象等」の記載を解消した。
継続企業の前提に関する重要事象等とは?
企業が作成する財務諸表は、継続企業の前提、つまり企業が将来にわたり永続的に事業活動を行うことを前提に作成されている。
しかし、企業はさまざまなリスクにさらされて事業活動を営んでおり、将来にわたって事業活動を継続できるかどうかは確実なものではない。そこで、継続企業の前提に重要な疑義を生じさせるような事象又は状況が存在する場合であって、その事象又は状況を解消し、又は改善するための対応をしてもなお継続企業の前提に関する重要な不確実性が認められるときは、継続企業の前提に関する事項を財務諸表に注記することとされている。
先行投資により収益およびキャッシュ・フローのマイナスが続いている同社だが、「SP-03:エピシル® 口腔用液」の日本での販売が開始される蓋然性が高まったため、一定の経常的な収益を計上しうる事業構造への転換点に到達し、継続企業の前提に重要な疑義を生じさせるような事象は現時点で存在せず、またそのような状況に現時点で該当しないと判断した。
◎「エピシル® 口腔用液」の国内販売が開始
上記「継続企業の前提に関する重要事象等」の記載解消の要因として挙げていたとおり、2018年5月16日、国内販売独占販売権導出先であるMeiji Seika ファルマ株式会社により「SP-03:エピシル® 口腔用液」の販売が開始された。同社初の販売開始製品となる。なお、会社側が発表済の2018年12月期業績予想には織り込まれているため予想の変更は行わない。
◎借入限度額10億円のコミットメントライン契約(※)を締結
2018年6月13日、株式会社三井住友銀行と、借入限度額10億円、契約締結日6月15日、契約期間末日2019年12月30日、無担保のコミットメントライン契約を同日開催の同社取締役会で決議した。
同社開発品のうちSP-03(日本)は今年5月に日本国内で販売が開始し、同じくSP-01(中国)及びSP-03(中国)は既に臨床試験等の開発が完了、当局による承認審査の段階にあるが、これらの事業化においては、製品の仕入、販売及び在庫保有という流通活動に伴い、運転資金需要が発生する。
また、SP-02(日本等)は現在最終臨床試験(第Ⅱ相試験)を実施中であり、SP-04(日本等)は今下期に最終臨床試験(第Ⅲ相試験)を開始する予定で、開発投資への資金需要も生じている。
こうした資金需要に対して、同社は手元資金(2018年3月末残高約27億円)及び2017年11月に締結した銀行当座貸越契約(総額26億円)によって対応するという基本方針で財務運営を図ってきたが、株式会社三井住友銀行が同社事業を高く評価した結果、無担保による更なる与信枠として今回のコミットメント契約を締結することとなった。
この結果、同社は財源の拡充と多様化によって、資本政策上、大きなメリットを得ることができた。
※コミットメントライン契約
企業と銀行が予め契約した期間・融資枠の範囲内で、企業の請求に基づき、銀行が融資を実行することを約束(コミット)する契約。
前年同期にあった新株発行による収入がなく、キャッシュポジションは前年同期に比べ12億円低下した。
(3)トピックス
◎「継続企業の前提に関する重要事象等」の記載を解消
2018年5月15日、「2018年12月期 第1四半期決算短信」において、「継続企業の前提に関する重要事象等」の記載を解消した。
継続企業の前提に関する重要事象等とは?
企業が作成する財務諸表は、継続企業の前提、つまり企業が将来にわたり永続的に事業活動を行うことを前提に作成されている。
しかし、企業はさまざまなリスクにさらされて事業活動を営んでおり、将来にわたって事業活動を継続できるかどうかは確実なものではない。そこで、継続企業の前提に重要な疑義を生じさせるような事象又は状況が存在する場合であって、その事象又は状況を解消し、又は改善するための対応をしてもなお継続企業の前提に関する重要な不確実性が認められるときは、継続企業の前提に関する事項を財務諸表に注記することとされている。
先行投資により収益およびキャッシュ・フローのマイナスが続いている同社だが、「SP-03:エピシル® 口腔用液」の日本での販売が開始される蓋然性が高まったため、一定の経常的な収益を計上しうる事業構造への転換点に到達し、継続企業の前提に重要な疑義を生じさせるような事象は現時点で存在せず、またそのような状況に現時点で該当しないと判断した。
◎「エピシル® 口腔用液」の国内販売が開始
上記「継続企業の前提に関する重要事象等」の記載解消の要因として挙げていたとおり、2018年5月16日、国内販売独占販売権導出先であるMeiji Seika ファルマ株式会社により「SP-03:エピシル® 口腔用液」の販売が開始された。同社初の販売開始製品となる。なお、会社側が発表済の2018年12月期業績予想には織り込まれているため予想の変更は行わない。
◎借入限度額10億円のコミットメントライン契約(※)を締結
2018年6月13日、株式会社三井住友銀行と、借入限度額10億円、契約締結日6月15日、契約期間末日2019年12月30日、無担保のコミットメントライン契約を同日開催の同社取締役会で決議した。
同社開発品のうちSP-03(日本)は今年5月に日本国内で販売が開始し、同じくSP-01(中国)及びSP-03(中国)は既に臨床試験等の開発が完了、当局による承認審査の段階にあるが、これらの事業化においては、製品の仕入、販売及び在庫保有という流通活動に伴い、運転資金需要が発生する。
また、SP-02(日本等)は現在最終臨床試験(第Ⅱ相試験)を実施中であり、SP-04(日本等)は今下期に最終臨床試験(第Ⅲ相試験)を開始する予定で、開発投資への資金需要も生じている。
こうした資金需要に対して、同社は手元資金(2018年3月末残高約27億円)及び2017年11月に締結した銀行当座貸越契約(総額26億円)によって対応するという基本方針で財務運営を図ってきたが、株式会社三井住友銀行が同社事業を高く評価した結果、無担保による更なる与信枠として今回のコミットメント契約を締結することとなった。
この結果、同社は財源の拡充と多様化によって、資本政策上、大きなメリットを得ることができた。
※コミットメントライン契約
企業と銀行が予め契約した期間・融資枠の範囲内で、企業の請求に基づき、銀行が融資を実行することを約束(コミット)する契約。
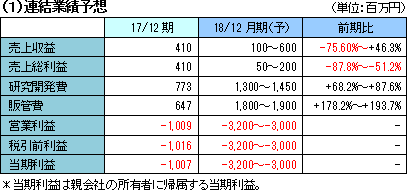 業績予想に変更無し。SP-01、SP-03の販売開始で売上収益拡大も、開発費用増加で損失幅も拡大。
業績予想に変更は無い。売上においては販売開始時期、コストにおいては臨床試験などの開始及び終了時期には不確実性があり、現時点で特定することは困難であるため業績予想はレンジ形式によって発表している。
(売上収益)
前期未達だったSP-01の中国承認マイルストン23百万円および製品販売、SP-03の日本における製品販売や中国での導出先Lee’s Pharmaからの承認マイルストンなどを見込んでいる。
(研究開発費)
SP-02のアジアにおける最終試験となる第Ⅱ相国際共同試験終了までの費用、SP-04の日本及び中国における次相臨床試験費用が主な項目。その他に、SP-01の市販後調査費用、SP-03の中国承認審査の対応費用などがある。
(販管費)
SP-01およびSP-03の中国マーケティング活動費、中国におけるセールス体制構築費用および全社体制の維持費用、SP-01およびSP-03の無形資産償却費用が中心。無形資産償却は販売開始年度から特許期限までの期間按分の均等償却で、現在の知財ポートフォリオにおいては、SP-01は2024年まで、SP-03は2025年までである。
業績予想に変更無し。SP-01、SP-03の販売開始で売上収益拡大も、開発費用増加で損失幅も拡大。
業績予想に変更は無い。売上においては販売開始時期、コストにおいては臨床試験などの開始及び終了時期には不確実性があり、現時点で特定することは困難であるため業績予想はレンジ形式によって発表している。
(売上収益)
前期未達だったSP-01の中国承認マイルストン23百万円および製品販売、SP-03の日本における製品販売や中国での導出先Lee’s Pharmaからの承認マイルストンなどを見込んでいる。
(研究開発費)
SP-02のアジアにおける最終試験となる第Ⅱ相国際共同試験終了までの費用、SP-04の日本及び中国における次相臨床試験費用が主な項目。その他に、SP-01の市販後調査費用、SP-03の中国承認審査の対応費用などがある。
(販管費)
SP-01およびSP-03の中国マーケティング活動費、中国におけるセールス体制構築費用および全社体制の維持費用、SP-01およびSP-03の無形資産償却費用が中心。無形資産償却は販売開始年度から特許期限までの期間按分の均等償却で、現在の知財ポートフォリオにおいては、SP-01は2024年まで、SP-03は2025年までである。
 ◎コーポレートガバナンス報告書
最終更新日:2018年4月2日
<実施しない主な原則とその理由>
「当社は、コーポレートガバナンス・コードの基本原則をすべて実施しています。」と記載している。
◎コーポレートガバナンス報告書
最終更新日:2018年4月2日
<実施しない主な原則とその理由>
「当社は、コーポレートガバナンス・コードの基本原則をすべて実施しています。」と記載している。



