ブリッジレポート:(7776)セルシード vol.1
| (7776:JASDAQ NEO) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
長谷川 幸雄 |
||
所在地 |
東京都新宿区若松町33-8 アール・ビル新宿 |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(8/20現在データ) |
|
||||||||||||||||||||||||
| 今回のポイント |
 |
|
| 会社概要 |
|
尚、「細胞シート再生医療事業」は製薬メーカーの創薬に相当するもので、基礎研究・前臨床研究から始まり、臨床試験、薬事許認可取得・薬価収載等の過程を経て収益化される。「再生医療支援事業」は既に製品を販売して売上高を計上しているが、「細胞シート再生医療事業」は現在事業化準備段階にあり、未だ売上計上には至っていない(10/12期から売上が計上される予定)。 <沿革>
2001年5月、現在社長を務める長谷川幸雄氏が、東京女子医科大学の岡野教授の提唱する「細胞シート工学」に基づく再生医療事業を目的に(株)セルシードを設立した。長谷川社長はPh.D.(英語圏で授与されている学位で、日本の博士に相当する)を有し、米国クリーブランド・クリニック(米国のトップ病院の一つで、治療、研究、教育のいずれでも評価が高く、特に心臓病治療ではNO.1.)の博士研究員、外資系製薬メーカー(旧ファルマシア・バイオテク)の研究開発室長(製品開発や知財戦略の推進等を手掛けた)等の経歴を持つ。もっとも、再生医療に携わっていた訳ではなく、また、長谷川社長が「細胞シート工学」と出会った1995年頃は、遺伝子治療の将来性に注目する専門家が多く、再生医療は注目度が低かった。このため、「細胞シート工学」の評価も十分になされていなかったが、長谷川社長はこれまでの医療を根本的に変革するようなその大きな可能性に惹かれたと言う。会社設立から暫らくは研究開発が中心で、本格的に事業が動き出したのは、フランス・リヨン国立病院と「角膜再生上皮シート」の治験の実施及び製造委託で基本合意した07年1月以降である。同年9月に「細胞シート」の作製に不可欠な温度応答性細胞培養器材「UpCell」の国内販売を開始。08年10月には欧州における細胞シート再生医療医薬品の研究開発を目的に子会社CellSeed Europe SARL(現セルシード フランス:CellSeed France SARL)を仏リヨンに設立。10年3月にはJASDAQ NEOに株式を上場し、同年6月に欧州における細胞シート再生医療医薬品のマーケティングや販売を目的にセルシード ヨーロッパ (CellSeed Europe Ltd.)を英ロンドンに設立した。 |
| 基盤技術 |
|
(1)「細胞シート工学」と「細胞シート再生医療」
再生医療とは、自分自身の細胞を使い、その再生能力を活用して機能障害や機能欠損に陥った組織や臓器の再生を図る先端医療である。現在、再生医療として様々な手法が考えられているが、同社は「細胞シート工学」を技術基盤とし、あらゆる組織や臓器の再生の可能性を追求している。人間の細胞は、目に見えないところで絶えず死と再生を繰り返しており、例えば、胃腸の上皮細胞等のように早いものでは1~3日、骨細胞では骨全体の3~5%ずつが90日のサイクルで再生されていると言う。こうした再生を可能にしているのが幹細胞(新陳代謝を司り細胞の元となる)と呼ばれる細胞で、同社が基盤技術とする「細胞シート工学」は、“誰もが持ち、簡単に採取可能な幹細胞”をシート状に培養し(「細胞シート」の作製)、これを患部に移植し再生を促す(同社は、この治療法を「細胞シート再生医療」と名付けた)。 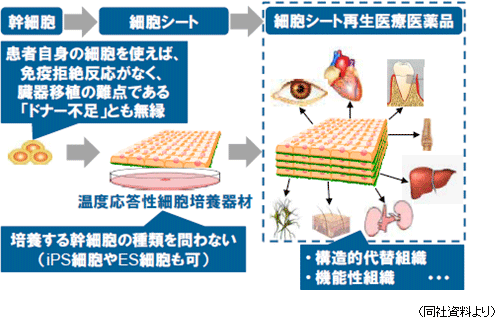 また、現在、臨床研究段階にある「心筋再生パッチ」(心筋再生用の「細胞シート」)は拡張型心筋症や心筋梗塞等の虚血性心疾患の治療を目的としており、患者の太腿から採取した筋芽細胞(後に筋線維になる原始筋細胞)を原料として温度応答性細胞培養器材を用いて細胞シートを作製し患部に移植する。移植した細胞シートから分泌されるサイトカイン(ホルモン様の低分子量の蛋白質で各種の細胞から分泌され、免疫反応の強さと期間の調節や細胞間での情報交換に使われる)等の物質が、弱った心筋組織の活性化や体内を遊走している幹細胞を含む細胞の誘導による組織の修復及び血管の新生を促進して患部組織を再生する(という作用メカニズムを想定して研究を進めている)。現在、心臓病の再生医療は患部に注射で再生細胞を注入(移植)し再生を促す手法が用いられているが、移植された細胞の定着率が悪い。これに対して、心筋再生パッチを用いた治療の場合、移植細胞の患部定着率が高く、より大きな効果が期待できると考えられている。 (2)温度応答性細胞培養器材「UpCell」
細胞シートは、現在、世界で同社だけが製造している細胞シート回収用温度応答性細胞培養器材(製品名:「UpCell」)を用いて初めて作製可能であり、世界で初めて東京女子医科大学の岡野光夫教授が考案し、同社がそのコンセプトを「UpCell」として製品化した。「UpCell」には、「温度応答性ポリマー」の一種であるポリ-N-イソプロピルアクリルアミド(PIPAAm)が使われている。「温度応答性ポリマー」とは、その名のとおり温度によって分子構造を変える性質(温度応答性)を持つポリマーの総称で、PIPAAmを器材(シャーレ)表面にナノテクノロジーを駆使して共有結合で固定すると、培養器材表面は32℃以上で細胞が付着できる適度な疎水性(水分を弾く性質)になり、32℃以下では細胞が付着できない親水性(水分を含む性質)になる。 一般に細胞は接着蛋白質(「細胞外マトリックス(注)」)を分泌し自らを固定する事により増殖する性質を有し、言い換えると、接着蛋白質を分泌しながら自らをどこかに固定しないと増殖できないのだが、従来の培養方法では、培養した細胞をトリプシン等の蛋白質分解酵素を用いて接着蛋白質を分解して回収していた(接着蛋白質を分解する以外に培養細胞の回収方法が無かった)。つまり、従来の培養方法では、この酵素処理によりバラバラの細胞しか回収できず、細胞が有機的に結合した組織を回収する事ができなかった。一方、同社温度応答性細胞培養器材を用いた温度処理回収の場合、細胞をシート状かつ細胞外マトリックス等を保持した状態で回収できるため、患部定着率が高く増殖が容易だ(バラバラの細胞も接着蛋白質を分泌するため時間の経過と共に定着し細胞同士が結合するが、患部へ定着するとは限らない)。 通常の細胞培養方法と温度応答性細胞培養器材「UpCell」を用いた細胞培養方法の違い
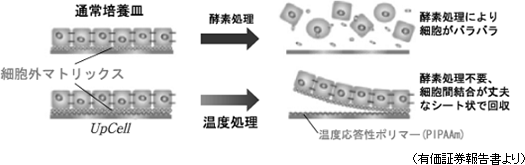 (注)細胞外マトリクス
細胞の外に存在する超分子構造体。細胞外の空間を充填すると共に、骨格的役割や細胞間結合の足場的役割を担う他、細胞の増殖・分化も制御する。細胞を細胞として機能させるために不可欠な物質。
(3)これまでの医療を根本的に変革する大きな可能性を秘めた「細胞シート工学」
このように、温度応答性細胞培養器材によって作製・回収した「細胞シート」を用いて組織・臓器を再構築する技術が「細胞シート工学」であり、特徴をまとめると次のようになる。
 |
| 事業セグメント |
|
(1)再生医療支援事業
細胞シート再生医療の基盤ツールである温度応答性細胞培養器材及びその応用製品を開発・製造し、世界各国の大学・研究機関等に提供している。当事業は細胞シート再生医療事業の提携先開拓にも有効で、収益だけを目的とした事業ではない。限られた資金や人員の有効活用を図るべく外注や提携を積極的に活用している事も特徴で、製品の研究開発は外部組織が有する最先端の基礎研究成果等の活用を図るべく東京女子医科大学等との共同研究を行い、製造においては多額の設備投資を必要とする一部の工程を外注している。またマーケティング及び販売では、フナコシ(株)、(株)島津ジーエルシー、和光純薬工業(株)、米国Thermo Fisher Scientific Inc.といった同社製品のユーザー層(大学・研究機関等)を顧客とする企業を販売代理店としている。また、独立行政法人新エネルギー産業技術総合開発機構(NEDO)のiPS細胞産業応用プロジェクト(「iPS細胞等幹細胞産業応用促進基盤技術開発」)において、国立成育医療センター等と共同でiPS細胞の培養・回収に適した温度応答性細胞培養器材の研究開発も進めている。 (2)細胞シート再生医療事業
細胞シート再生医療医薬品(各種用途の「細胞シート」)及びその応用製品を販売する。現在、東京女子医大、大阪大学、及び東海大学と共同で5つの再生医療製品パイプライン(新薬候補)の研究開発を進めている。
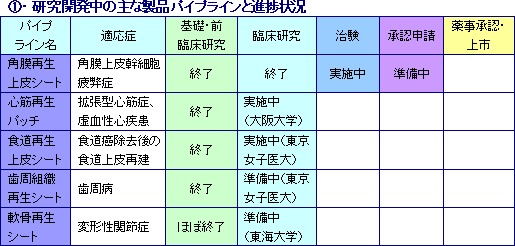 角膜再生上皮シート
角膜上皮幹細胞疲弊症を適応症とした治験をフランスで進めており、全欧州30カ国での承認申請及び欧州人道的使用(後述)に向けた準備が進行中。
心筋再生パッチ
根本的な治療法が確立されていない心疾患(虚血性心疾患、拡張型心筋症等)の治療を目的として、大阪大学において臨床研究が実施されている(第1例患者が補助人工心臓を外して退院する等の成果が出ている)。
食道再生上皮シート
食道癌除去後に発生する炎症反応と食道狭窄の抑制・防止を目的としており、東京女子医科大学における臨床研究での複数例の移植手術では、食道上皮の再建、炎症反応の抑制、食道狭窄の防止等で効果が見られている。
歯周組織再生シート
患者自身の親知らず等から採取した歯根膜細胞を原料とする細胞シートを歯周病患部に貼付する事で、中度~重度の歯周病によって失われた歯周組織の再生を促進する。
軟骨再生シート
変形性関節症の治療を目的としており、患者自身の軟骨細胞から作製した細胞シートを初期~中期段階の変形性関節症患部に貼付し摩耗した軟骨表面を元通りに近い滑らかな状態に戻すというコンセプトの製品。
 |
| マイルストーン開示に係る事業計画 |
 尚、日本ではなく、フランスで治験が進められているのは、①リヨン国立病院のオディール・ダムール細胞組織バンク所長が同社の技術を高く評価している事(もともと同氏から協力依頼を受けて関係が始まった)、②フランスは再生医療の制度整備が進んでいる事、更には③販売承認までの期間が短くコストを抑える事ができる事(欧州医薬品庁(EMA)の承認を取得すると、EU参加国など30ヶ国での販売が可能になる)等が理由。②については、わかりやすく言うと、「フランスでは再生医療における承認取得に向けたガイドラインがはっきりと示されており、日本のように手探りで進める必要が無い」という事。更に言えば、海外で承認を取得すると、基準があいまいな日本でもスムーズに承認が取得できる可能性が出て来ている。 また、人道的使用制度とは、他に治療法がない重篤な疾患に対して人道的見地から薬事審査当局が一定の条件の下に販売承認前の製品の使用を認める欧州の薬事制度である。  (1)欧州における角膜再生上皮シート事業化準備の状況
フランスで行っている「角膜再生上皮シート」の治験観察が8月~9月に終了し、監査を経て10月頃に最終報告書が提出される。これを踏まえて欧州医薬品庁(EMA)へ販売承認申請を提出する予定だ。承認取得に1年程度を要するが、これに先立つ2010年後半から欧州主要国の人道的使用制度を活用して同シートの有償提供を開始する。また、フランスでの治験最終結果を踏まえて、米国での販売に向けFDA(米国食品医薬品局)との事前相談も開始する予定。尚、承認申請提出に向け、2009年夏からEMAに対して専門的アドバイス(Scientific Advice)を求めており、当第2四半期(4-6月)に第2回目のScientific Adviceを取得した。Scientific Adviceの取得は、承認申請する薬剤(同社の場合は「角膜再生上皮シート」)に対するEMAによる評価の現われであり、一般的にはScientific Adviceを取得する事ができれば、少なくとも80%程度の確率で承認を取得できるようだ。  ②製造及び販売
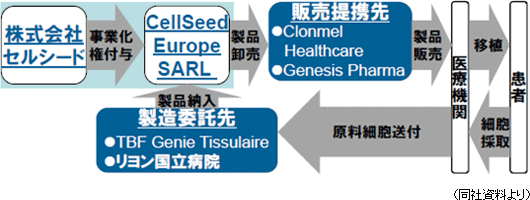
製造面では、製造委託先であるTBF Genie Tissulaire(軟骨の再生医療及び必要な組織工学製品の製造を手掛けている)に対する技術移転作業及びフランスのリヨン国立病院での製造設備の整備を進めている。販売面では、ドイツのStadaグループのClonmel Healthcare Limited(アイルランド)及びギリシャのGenesis Pharma と販売提携契約を正式に締結し(同社が事業化権を付与したセルシード ヨーロッパを通じて製品が供給される)、人道的使用へ向けた準備と併せて販売提携先との実務準備(協同体制構築へ向けた協議やターゲット医師との関係構築準備等)を進めている。
 ③Eurostars Projectの獲得
子会社セルシード フランスがリヨン国立病院、Genesis Pharma、及びParacelsus医科大学(オーストリア)と共に進めているプロジェクトが、Eurostars Projectに採択され支援を受ける事となった(計画ベースの総費用約3.7百万ユーロのうちセルシード フランス負担分に相当する1.8~1.9百万ユーロを助成金として受け取ることとなる見込み)。Eurostars Projectは、EUREKA(欧州諸国が参加する研究開発振興機関)が運営する公的な研究開発助成プログラムで、欧州に本社を置く研究開発型中小企業による事業化志向研究開発の支援を目的としている。今回採択されたセルシード フランスグループのプロジェクトは、角膜再生上皮シートの欧州上市準備の総仕上げとして、商業化を前提としたGMP(Good Manufacturing Practice:医薬品等の品質管理基準)製造・輸送体制の確認及び多施設分散型小規模実験の実施・評価を内容としており(期間は30ヶ月)、実製品を用いた製造・輸送体制の最終確認を行うと共に、欧州各国の有力眼科医師(10名以上を想定)に同社製品の使用機会を提供する予定(人道的使用の推進効果に加え、薬価取得に際してポジティブな意見を得る事ができ、また、上市後の本格使用へつながる)。 (2)心筋再生パッチ臨床研究の状況
2007年に大阪大学医学部において拡張型心筋症患者に対する心筋再生パッチ移植治療の臨床研究を開始した。この臨床研究では、患者の太腿から採取した筋芽細胞を原料として作製された心筋再生パッチを使用し、拡張型心筋症第1例では、補助人工心臓を装着してドナー心臓の移植を待っていた患者に対して、10枚以上の心筋再生パッチを積層して無縫合で移植した。この患者は移植後約3か月間で補助人工心臓を外しても心機能を正常に維持できるようになり、更にその約3か月後までに心機能が充分に回復したため、07年12月に退院した。また、虚血性心疾患(心筋梗塞等)を対象とした臨床研究を2010年に開始した。 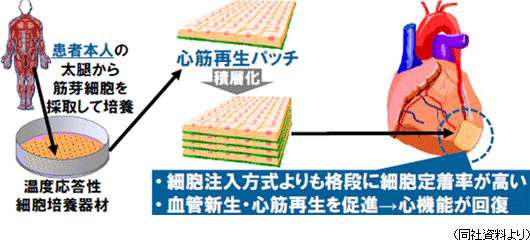 (3)米クリーブランド・クリニックとの腱(けん)再生医療共同研究の開始
米クリーブランド・クリニックは、1,000床以上のベッドを有し、年間延べ420万人の患者を受け入れている米国有数規模の総合病院。治療、研究、教育のいずれにおいても評価が高く、U.S. News & World Report が毎年行っている「米国のベストホスピタル」ランキングの多くの部門で上位を占めており、特に心臓治療部門では1995年以来、ランキング第1位を維持している。今回の共同研究は、腱(骨と筋肉を結合している人体組織で、代表的な腱としてアキレス腱等がある)の再生を最終目的としており、具体的には、細胞シート工学を用いて「腱細胞シート」を作製し、損傷を負った腱を修復させようとするもの。同社は腱(けん)再生医療により細胞シート再生医療医薬品パイプラインの増強を図る考えで、腱の再生医療はあまり例が無く、競合相手も少ないと見られている。 |
| 2010年12月期上期決算 |
 売上高22百万円、経常損失346百万円
上期決算の開示は今期からのため前年同期との比較はできないが、期初予想との比較では、売上が予想を下回る一方、損失は予想したほど拡大しなかった。上期は再生医療支援事業(温度応答性細胞培養器材の販売)の売上のみを想定していたが、共同研究先向けの大型案件の納品が下半期へずれ込んだ事と欧州での販売の伸び悩みにより期初の予想を下回った。後者については、海外先進各国の予想以上の景気低迷と欧州での温度応答性細胞培養器材の販売の実質的初年度となった前期の積極的な販売促進活動の反動(今期需要の一部を先食い)が要因である。一方、損益面では、売上が予想を下回った事による変動費の下振れと上期に計上を予定していた欧州角膜関連研究費用等の下期へのずれ込みで予想したほど損失が拡大しなかった。欧州角膜関連研究費用としては、共同研究先であるリヨン国立病院に対する角膜再生上皮シート製造受託準備支援費用、角膜再生上皮シート欧州事業化準備のための費用の一部、及び国内研究機関に対する研究支援費用の一部等を挙げる事ができる。尚、公的助成プロジェクト(NEDOプロジェクト)の完了に伴い、前受金に計上していた補助金など計226百万円を営業外収益に計上した。 (2)財政状態及びキャッシュ・フロー(CF)
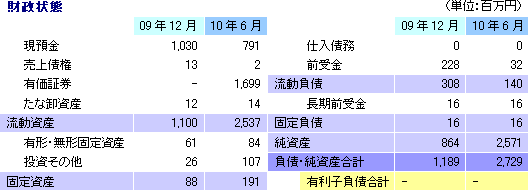
第2四半期末の総資産は前期末比1,539百万円増の2,729百万円。3月の株式上場(IPO)に伴う資金調達により、手許資金(現預金及び短期国債)及び純資産が増加。一方、営業外収益への計上により前受金が減少した。フリーCFが大幅なマイナスとなったが、これは短期的な余資運用の一環としての有価証券(短期国債)の取得が主な要因。約25億円の手元資金を確保しており、黒字転換が見込まれる12/12期まで資金面での不安は少ない。
 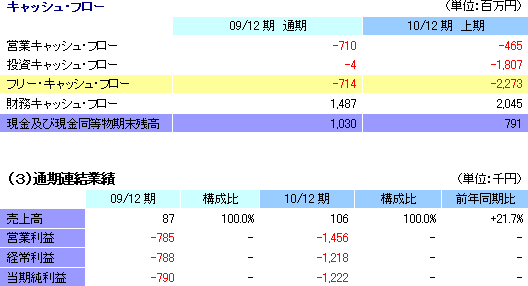 通期業績予想に変更は無く、前期比21.7%の増収、1,218百万円の経常損失
再生医療支援事業において、下期にずれ込んだ案件の売上計上に加え、6月に2種類の新商品を投入した効果や海外市場(特にアジア地域)における温度応答性細胞培養器材の販促効果が見込めるとして通期の売上予想を据え置いた。また、利益面では、下期にずれ込んだ欧州角膜関連研究費用等が予定通り計上される。前期との比較では、人道的使用制度に基づく角膜再生上皮シートの売上17 百万円等で増収が見込まれるものの、角膜再生上皮シート関連の先行投資が負担となり損失が拡大する。
|
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




