ブリッジレポート:(7776)セルシード vol.2
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
長谷川 幸雄 |
||
所在地 |
東京都新宿区若松町33-8 アール・ビル新宿 |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(11/20現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
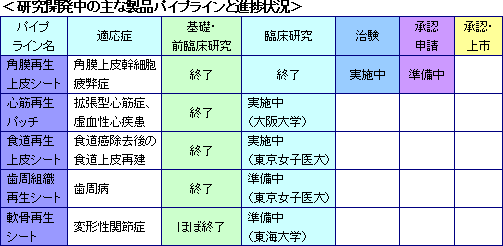
再生医療支援事業
細胞シート再生医療の基盤ツールである温度応答性細胞培養器材及びその応用製品を開発・製造(多額の設備投資を必要とする一部の工程は外部委託)し、世界各国の大学・研究機関等に提供している。当事業は細胞シート再生医療事業の提携先開拓のための戦略的な意義をも有し、収益だけを目的とした事業ではない。
細胞シート再生医療事業
細胞シート再生医療医薬品(各種用途の「細胞シート」)及びその応用製品を販売する。現在、東京女子医大、大阪大学、及び東海大学と共同で5つの再生医療製品パイプライン(新薬候補)の研究開発を進めている。
 |
| 2010年12月期第3四半期決算 |
 先行投資が負担となり829百万円の営業損失
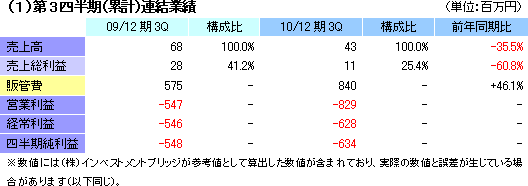
国内及び欧州での温度応答性細胞培養器材の販売により売上高43百万円を計上したが、前年同期比25.4%の減収。実質的初年度となった前期の積極的な販売促進活動の反動に加え、景気低迷や円高の影響もあり、欧州での販売が苦戦。国内も大口顧客向け案件の一部が来期以降に持ち越しとなった事等で売上が減少した。損益面では、温度応答性細胞培養器材の販売促進費用に加え、リヨン国立病院に対する製造受託準備支援費用、欧州事業化準備費用、及び国内研究機関に対する研究支援費用等、角膜再生上皮シート関連での先行投資も負担となり営業損失が前年同期の547百万円から829百万円に拡大した。経常損失が628百万円にとどまったのは、公的助成プロジェクト(NEDOプロジェクト)の完了に伴い、前受金に計上していた226百万円を補助金収入として営業外収益に計上したため。セグメント別では、再生医療支援事業が売上高43百万円(前年同期は68百万円)、営業損失53百万円(同28百万円の損失)。細胞シート再生医療事業が営業損失404百万円(同301百万円の損失)。 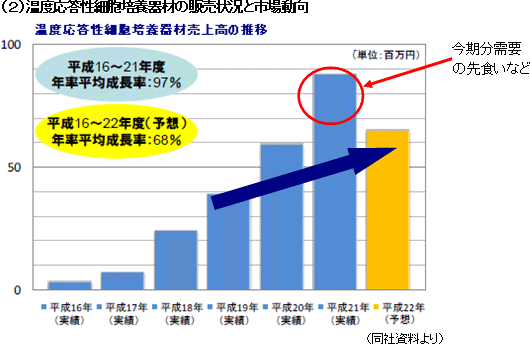 (2)財政状態及びキャッシュ・フロー(CF)
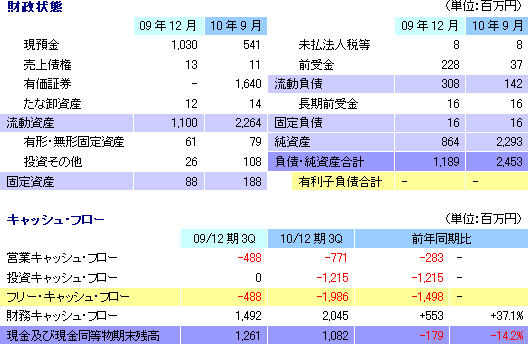
第3四半期末の総資産は前期末比1,263百万円増の2,453百万円。3月の株式上場(IPO)に伴う資金調達により、手許資金(現預金及び短期国債)及び純資産が増加。一方、営業外収益への計上により前受金が減少した。フリーCFが大幅なマイナスとなったが、これは短期的な余資運用の一環としての有価証券(短期国債)の取得が主な要因。
 |
| 2010年12月期業績予想 |
 角膜再生上皮シート製造の準備の遅れで業績予想を修正
売上高予想を106百万円から65百万円に引き下げた。国内外での再生医療支援事業の苦戦に加え、細胞シート再生医療事業も、角膜再生上皮シートの製造準備の遅れで、下期に想定していた欧州人道的使用(後述)による角膜再生上皮シートの売上高17百万円が見込めなくなった。ただ、角膜再生上皮シート製造の準備の遅れ(準備完了時期の変更)に伴い、今期中に予定していた販売承認申請(製造体制と販売体制の確立を必要とする)を来期に変更したため、今期の業績予想に織り込んでいた角膜再生上皮シート関連研究開発費の一部の計上が来期に持ち越しとなった。このため、営業損失が期初予想を下回る見込みで、経常損益、当期純損益も修正された。 尚、欧州人道的使用とは、欧州主要各国の許可に基づく薬事承認前医薬品のヒト患者への提供で、有償での提供が可能である。また、マイルストーン開示に係る来期以降の事業計画は変更していないが、精査した上で年度明けに速やかに開示するとしている。 (2)欧州角膜再生上皮シート事業の動向
07年からリヨン国立病院(病床数約6,000床、治験受け入れ年間約500件)において、重度の視覚障害を伴う角膜上皮幹細胞疲弊症を適応症とする治験が進められ、この9月に全症例の経過観察が終了した。同病院からの治験の最終報告書の受領はこれからだが、本年4月の治験責任医師のキャロル・ブリヨン教授の世界角膜学会での発表によると、この発表までに経過観察が終了した16例のうち14例(87.5%)で製品移植前よりも症状が改善したと言う(一般的な医薬品の場合、30%程度で改善傾向が見られれば有効とされる)。尚、角膜上皮幹細胞疲弊症とは、重度の視覚障害を伴う目の病気で未だに治療法が確立されていない難病である。欧州角膜再生上皮シート事業の遅れが10/12期の業績予想修正の一因となったが、これは効果・効能と言った薬効の面での問題ではなく、製造面(工業化段階)での問題である。製造委託先は、リヨン国立病院と軟骨の再生医療及び同医療に必要な組織工学製品の製造を手掛けるTBF Genie Tissulaire社(共にフランス)だが、現在、リヨン国立病院では製造設備の整備を進めており、TBF Genie Tissulaire社は技術移転(製造技術の受け入れ)が進行中である。リヨン国立病院は治験に際して、実際に患者の口腔粘膜上皮細胞(口の中の細胞)から角膜再生上皮シートを培養(製造)したのだが、本来が病院でありメーカーではない。このため、GMP(Good Manufacturing Practice:医薬品等の品質管理基準)に適合した製造設備の整備が必要であり、その整備に当初の想定よりも時間を必要としている。また、再生医療に必要な組織工学製品の製造で実績があるTBF Genie Tissulaire社も、セルシード社製品の製造は初めてのため当初想定よりも準備に時間を要している模様。ただ、いずれも時間が解決してくれる問題である。 尚、販売面では、ドイツのStadaグループのClonmel Healthcare Limited(アイルランド)及びギリシャのGenesis Pharma と販売提携契約を正式に締結している(同社が事業化権を付与したセルシード ヨーロッパを通じて製品が供給される)。 (3)Eurostars Project
子会社セルシード フランスがリヨン国立病院、Genesis Pharma、及びParacelsus医科大学(オーストリア)と共に進めている角膜再生上皮シートプロジェクトが、Eurostars Projectに採択され支援を受ける事となった。尚、Eurostars Projectとは、EUREKA(欧州諸国が参加する研究開発振興機関)が運営する公的な研究開発助成プログラムで、欧州に本社を置く研究開発型中小企業による事業化志向研究開発の支援を目的としている。今回採択されたセルシード フランスグループのプロジェクトは、角膜再生上皮シートの欧州上市準備の総仕上げとして、商業化を前提としたGMP(Good Manufacturing Practice:医薬品等の品質管理基準)製造・輸送体制の確認及び多施設分散型小規模実験の実施・評価を内容としており(期間は30ヶ月)、実製品を用いた製造・輸送体制の最終確認を行うと共に、欧州各国の有力眼科医師(10名以上を想定)に同社製品の使用機会を提供する。 わかりやすく言うと、助成金を受け取って、GMPに則した製造及び輸送体制ができているか否かの確認や(実際の商業化段階でのトラブル発生の芽を事前に摘み取る事ができる)、欧州各国の有力眼科医師との関係構築(角膜再生上皮シートのファン作り)ができる訳だ。有力眼科医師とのパイプを作る事によって、人道的使用の推進効果、薬価取得に際してのポジティブな評価・意見、更には上市後のスムーズな本格使用等の効果が期待できる。 |
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




