ブリッジレポート:(7776)セルシード vol.9
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
長谷川 幸雄 |
||
所在地 |
東京都新宿区若松町33-8 アール・ビル新宿 |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2011年12月 | 86 | -1,418 | -1,358 | -1,442 |
| 2010年12月 | 66 | -1,204 | -1,002 | -1,009 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(8/30現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
細胞シート再生医療事業
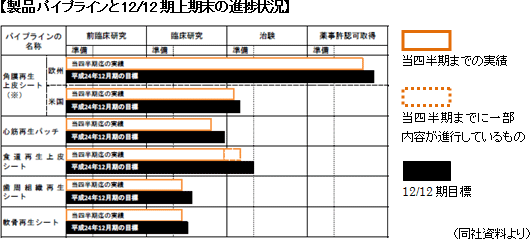
細胞シート再生医療医薬品(各種用途の「細胞シート」)及びその応用製品を販売する。現在、共同研究先と5つの再生医療医薬品パイプライン(新薬候補)の研究開発を進めている。
再生医療支援事業
細胞シート再生医療の基盤ツールである温度応答性細胞培養器材(世界で唯一当社が製造)及びその応用製品を開発・製造(多額の設備投資を必要とする一部の工程は外部委託)し、世界各国の大学・研究機関等に提供している。当事業は細胞シート再生医療事業の提携先開拓のための戦略的な意義をも有し、収益だけを目的とした事業ではない。
 |
| 2012年12月期上期決算 |
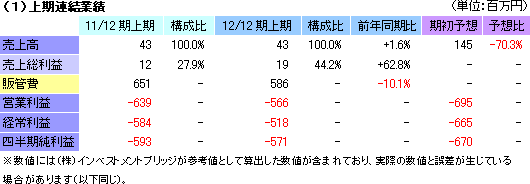 売上高43百万円(前年同期比1.6%増)、経常利益518百万円(前年同期は584百万円の損失)
売上高は前年同期比1.6%増の43百万円。細胞シート再生医療事業において計画していた米国角膜再生上皮シート事業にかかる米エマウス社からの一時金(150万ドル。2月に入金済み)の売上計上が下期にずれ込んだため、再生支援事業における温度応答性培養皿の売上43百万円のみにとどまった。利益面では、一部研究開発投資の下期へのずれ込み等で前年同期は380百万円を計上した研究開発費が340百万円に減少した他、全社的な支出計画の見直しもあり、販管費が586百万円と同10.1%減少。営業損失は566百万円となり、前年同期及び期初予想を上回った。  (2)経営合理化策の実施
同社は5月に発表した計画に従い、6月から役員報酬の減額(当面の間、全取締役・全監査役の役員報酬を50%減額)、従業員夏期賞与の支給見送り(全従業員について12年夏期賞与の支給を見送り)、及び希望退職の募集(正社員30名)を柱とする経営合理化策を実施した。役員報酬については従前から自主的減額を行っていたが、今回改めて経営合理化策として明文化したもので、希望退職の募集については30名が応募し、上期決算において退職一時金50百万円を特別損失に計上した。
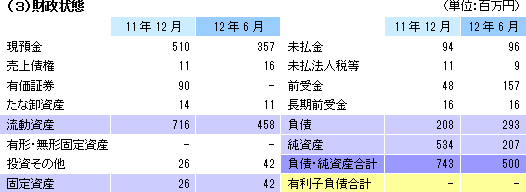 尚、新株予約権は昨年10月に野村證券(株)を割当先として設定したもの。調達可能最大額は1,000百万円(上限行使価格2,062.0円、下限行使価格824.8円)で、行使期間は3年間(行使期日:14年10月3日)。調達枠の残額は650百万円。  当面の財務運営
今後、欧州角膜再生上皮シート事業での多施設治験(後述)を進めるに当たって資金需要も発生するが(3年間で7億円程度が必要となる見込み)、エマウス社からの850万米ドルに加え、新株予約権を活用した資金調達枠650百万円がある他、来13/12期には提携を通じた資金の獲得として心筋再生パッチの共同研究開発にかかる提携一時金500百万円の受領が見込まれている。この他にも商談が進んでいる提携案件が複数あり、また、社会性の高い事業だけに公的補助金や助成金の獲得機会も多い。尚、欧州角膜再生上皮シート事業では、承認後の欧州30ヵ国でのスムーズな販売(承認前に認知度の向上を図る事で承認後のスムーズな販売につながる)及び無条件での販売承認取得を目的に多施設治験を実施する考えで、現在、その準備を進めている(現在審査中の販売承認申請は条件付きの承認についても想定したもの)。無条件での販売承認と条件付き販売承認で基本的な違いは無いのだが、一般的に条件付き販売承認としてよくある事例は、例えば毎年、EMAに対して1年間の治療実績の報告を求められることがある。 (4)研究開発の成果
4月に韓国で移植用「角膜再生上皮シート」に関する特許が成立した他、8月には食道再生上皮シートの臨床研究が終了した。
①移植用「角膜再生上皮シート」に関する韓国特許の成立
4月に角膜再生上皮シートの製造法及び利用方法に関する特許が韓国で成立した。アジアにおける重要市場の1つを抑える成果である。角膜再生上皮シートを用いた治療は、患者自身の口腔粘膜細胞を培養・増殖し、回収したシート状の角膜上皮用組織(角膜再生上皮シート)を角膜上皮幹細胞疲弊症等の角膜上皮疾患の治療に用いる。口腔粘膜細胞からなる角膜再生上皮シートは幹細胞を多く含んでおり、傷んだ角膜上皮組織を代替しながら効率よくかつ継続的に角膜上皮組織の再生を促す事が特徴。患者自身の細胞のみで形成されているため拒絶反応を惹き起こさないし、接着たんぱく質を保持したままの状態で回収されるため無縫合で患部に生着できる(手術時間が比較的短くて済む)。また、両眼性疾患の患者も治療できる可能性がある事も特徴だ(角膜上皮組織の再生には角膜から細胞を採取する方法もあるが、この場合、少なくとも片眼は細胞採取が可能な状態である必要がある)。 ②食道再生上皮シート(培養口腔粘膜上皮シート)移植による再生医療的治療)臨床研究終了
食道再生上皮シート(培養口腔粘膜上皮シート)移植による再生医療的治療の臨床研究が8月に終了した。この臨床研究は癌切除後に発生する食道狭窄の防止と治癒促進を目的としたもので(現状、良い治療法がない)、表在性扁平上皮がんについて内視鏡剥離手術を受けた患者を対象として08年に共同研究先が臨床研究を開始した。内視鏡を用いて広範囲に及ぶがんを一度に切除する「内視鏡的粘膜下層剥離術(ESD)」が食道がん治療にも普及しつつある。しかし、ESDによって広範囲の食道がん患部を切除した場合、切除後に生じる潰瘍が大きく、潰瘍に起因する狭窄が発生するケースがある(食道等の管器官の内径が小さくなる)。食道狭窄が発生すると、飲食物等が通過し難くなるため、患者は内視鏡を用いた拡張処置を頻繁に受ける必要があり大きな負担を強いられるが、食道再生上皮シートには、食道がんを内視鏡切除した部位への移植を通じて、当該部位の食道上皮を速やかに再建して潰瘍の発生を抑制し、狭窄を防止する効果が期待されている。 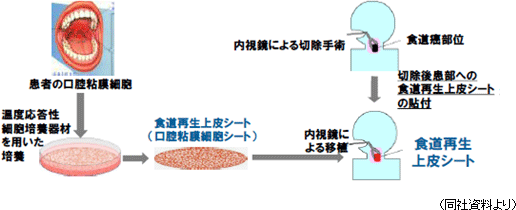 国内の食道がん(扁平性上皮がん)患者は8,000人/年程度だが、診断技術の進歩や内視鏡検査によって早期診断が通常化すれば、市場は数倍に拡大するとみられている。また、食道がんにおける内視鏡手術の市場は約1,600人/年(「8,000人/年」×「20%」)となるが、食道再生上皮シートを使えば、腫瘍周在性が2/3以上の患者でも、入院期間が短く、身体への負担が少ない内視鏡手術で対応できるため、この面からの市場拡大余地も大きいと思われる。 |
| 2012年12月期業績予想 |
 通期の業績予想に変更はなく、通期で売上高205百万円、経常損失1,520百万円が見込まれる
売上の内訳は、再生医療支援事業が76百万円、細胞シート再生医療事業が129百万円。細胞シート再生医療事業の売上はエマウス社から受領した契約一時金150万米ドルにかかるもの。欧州角膜再生上皮シート事業については、多施設分散型治験が始まる他、人道的使用制度に基づく製品提供について商談を進めていく。また、既に説明したとおり、エマウス社から共同研究開発基本契約に係る一時金850万米ドルの入金が予定されている。 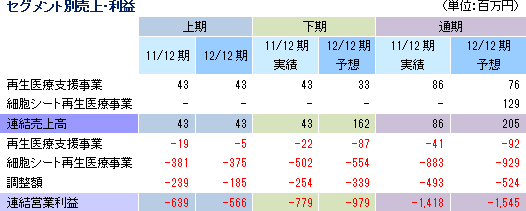 |
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




