ブリッジレポート:(7776)セルシード vol.10
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
長谷川 幸雄 |
||
所在地 |
東京都新宿区原町3-61 桂ビル4F |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2011年12月 | 86 | -1,418 | -1,358 | -1,442 |
| 2010年12月 | 66 | -1,204 | -1,002 | -1,009 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(3/19現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
事業は、各種用途向けに様々な種類の細胞シートを開発・製造・販売する「細胞シート再生医療事業」(売上計上は13/12期以降)と温度応答性細胞培養器材及びその応用製品の開発・製造・販売を行う「再生医療支援事業」とに分かれる。 「細胞シート再生医療事業」では、現在、共同研究先と5つの再生医療医薬品パイプライン(新薬候補)の研究開発を進めており、 「再生医療支援事業」では、細胞シート再生医療の基盤ツールである温度応答性細胞培養器材(世界で唯一当社が製造)及びその応用製品を開発・製造(多額の設備投資を必要とする一部の工程は外部委託)し、世界各国の大学・研究機関等に提供している。「再生医療支援事業」は細胞シート再生医療事業の提携先開拓のための戦略的な意義をも有し、収益だけを目的とした事業ではない。  |
| 2012年12月期決算 |
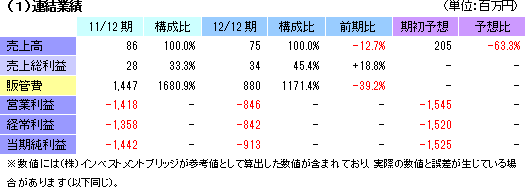 前期比12.7%の減収、842百万円の経常損失(前期は1,358百万円の損失)
売上は再生医療支援事業によるもので、細胞シート再生医療事業は5つのパイプラインが順調に進捗しているものの、売上計上はなかった。損益面では、経営合理化策(後述)に基づく支出抑制により、販管費において、研究開発費が前期の867百万円から461百万円に、その他の経費も579百万円から418百万円に、それぞれ減少。前期は1,418百万円だった営業損失が846百万円に縮小した。
 期初予想との差異要因
売上高の面では、米国Emmaus Medical Inc.(以下、エマウス社)との間で11年4月に締結した「米国における角膜再生上皮シート共同開発・事業化契約」に係る契約一時金150万米ドルを12年3月に受領したものの、売上計上しなかった事が116百万円の下振れ要因となった他、多施設分散型治験の延期に伴い、連動して進める予定だった角膜再生上皮シートの人道的使用を実施出来なかった事が13百万円の下振れ要因となった。損益面では、エマウス社からの一時金売上計上がなかった事で売上総利益が116百万円下振れしたものの、期初予想に織り込んでいなかった経営合理化策等による支出削減効果840百万円で損失が期初予想を下回った。 尚、米国での角膜再生上皮シート事業においては、既に動物実験が終了しており、医療機器ではなく、バイオロジックス(生物学的製剤)としての認定を受けている。FDA(the Food and Drug Administration:食品医薬品局)との早期交渉開始を目指している。 7件の特許が成立
・角膜再生上皮シート(2件) :移植用「角膜再生上皮シート」(韓国、4月発表)、移植用「角膜再生上皮シート」(韓国、11月発表)
・心筋再生パッチ :間葉系幹細胞又は胚性幹細胞からなる移植用「心筋再生パッチ」(日本、2月発表)
・心筋再生パッチ(2件) :移植用「心筋再生パッチ」(欧州、3月発表)、移植用「心筋再生パッチ」(日本、9月発表)
・移植用「軟骨細胞シート」(日本、2月発表)
・新型細胞培養器材「新規アクリルアミド誘導体」(日本、2月発表)
(2)継続企業の前提に関する注記(12/3月)への対応
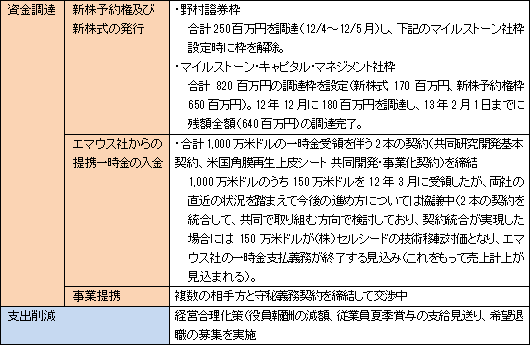
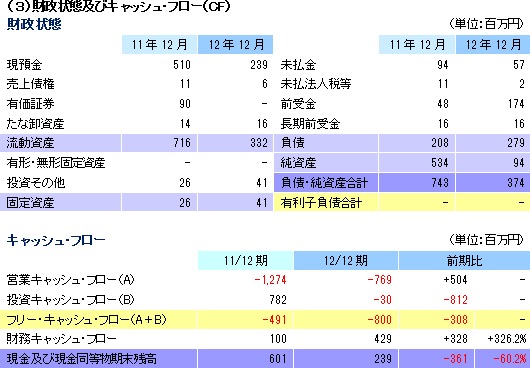
継続企業の前提に関する注記(12/3月)への対応策として、経営合理化策を発動して支出の削減に取組むと共に、12/4月~13/2月にかけて、新株予約権及び新株式の発行、エマウス社からの提携一時金の入金、及び事業提携により計1,180百万円の資金調達を行い、流動性を確保した。
経営合理化策について
尚、経営合理化策12年5月に役員報酬の減額、従業員夏期賞与の支給見送り、及び希望退職の募集(正社員30名)を柱とする経営合理化策を決議した。役員報酬については従前から自主的減額を行っていたが、改めて経営合理化策として明文化したもので、希望退職の募集については30名が応募し、上期決算において退職一時金50百万円を特別損失に計上した。
  |
| 中期経営計画(13/12期~15/12期) |
|
(1)環境認識
国内の再生医療関連事業の市場規模について、経済産業省では2020年に約8,700億円と予想しており、調査会社シードプランニングによると同年の市場規模は約1兆3,000億円。また、米国市場については、米国保健福祉省が、細胞療法、遺伝子治療、再生促進剤、美容応用、 その他関連機器類等も含めて、2020年にUS$300 billion(1ドル=90円換算で27兆円)と予想している(いずれも同社資料より。出所:12.11.16日本経済新聞朝刊、12.3.2経済産業大臣「新産業・新市場の創出に向けて」、米国Proteus Venture Partners ウェブサイト)。
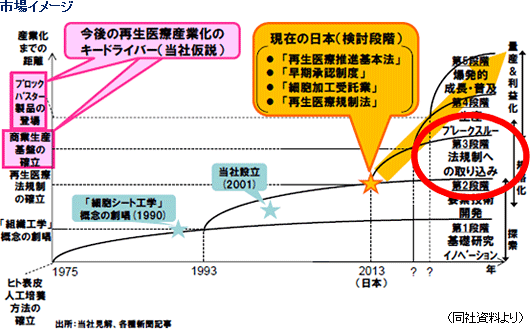 現在検討されている再生医療関連法案(いずれも「2013年通常国会への提出が検討されている」模様)
・再生医療推進基本法
・薬事法の改正(「早期承認制度」の創設) ・医療法の改正(「細胞加工受託業」の創設) ・再生医療規制法(安全性確保が目的) (2)同社技術基盤の優位性
現在、「細胞シート工学」だけが唯一「ヒト細胞のみからの組織の人工作製」という課題を原理的に解決しており、また、角膜再生上皮シート(仏国治験終了)、食道再生シート(臨床研究~治験準備)、心筋再生パッチ(臨床研究~治験)、歯周組織再生シート・軟骨再生シート(臨床研究)といった様に「細胞シート再生医療」の科学的なProof of Concept が多様な組織・疾患のヒト臨床で示されている。加えて、上市済み再生医療製品の殆どは皮膚と軟骨であり、上記の通り細胞シート再生医療の応用面での多様性は類を見ない。
 (3)「再生医療産業化」実現のキーワード(Automation、Allogeneic、Alliance)
再生医療の市場拡大には産業化(量産システムの構築と生産コストの低減)が不可欠であり、そのための実現のキーワードとして、「Automation(生産システムの自動化)」、「Allogeneic(他家細胞原料化の実現)」、「Alliance(産学連携・産産提携の戦略的活用)」が挙げられている。このため、同社は東京女子医科大学の岡野光夫教授グループと細胞シート生産自動化システムの共同開発に取組んでおり(独立行政法人日本学術振興会が先端的の研究の総合的かつ計画的な振興を目的に助成している最先端研究開発支援プログラム「FIRST」の一環として進められている)、今後、産学連携・産産提携の戦略的活用も積極的に進めていく考え。 (4)中期経営計画(13/12期~15/12期)の概要
同社は上記の事業環境を踏まえて、「事業提携」、「戦略投資」、「財務基盤」を3本柱として、「外部環境の変化を活用した新たな持続的成長モデルの構築」をビジョンとする中期経営計画の達成に取り組んでいく考え。
3つの柱 「事業提携」、「戦略投資」、「財務基盤」
事業提携 :事業提携により、細胞シート再生医療第1号製品の早期事業化を図る戦略投資 :中長期的な企業価値成長を目指した「戦略分野への先行投資」を行う 財務基盤 :収支バランスを改善し、持続的成長を支え得る「財務基盤」を確立する 「温度応答性細胞培養器材」は、
細胞シート再生医療基礎研究の”must-have” ⇒ 他社に先駆けたオープンイノベーション機会の獲得 細胞シート再生医療製品開発の”must-have” ⇒ 当社独自の価値付加・技術開発機会の獲得 細胞シート再生医療製品製造の”must-have” ⇒ 幅広い事業提携機会の獲得 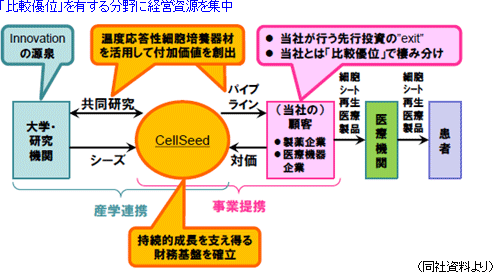 「事業提携」
細胞シート再生医療第1号製品の早期事業化に向け「事業提携」を進めていく考え。具体的には、13/12期~12/14期における実現を目指し、事業提携の内容と研究開発戦略の大胆かつ機動的な組み換えを検討する。角膜再生上皮シートについては、社内外の状況に対応して、欧州での開発・事業計画を再編する。
 「戦略投資」
中長期的な企業価値成長を目指した「戦略分野への先行投資」を実施していく考え。具体的には、比較優位を有する「シーズ製品化(規格化、工業生産工程確立等)」機能の更なる強化を念頭に、Innovationの源泉である大学・研究機関との産学連携により、温度応答性細胞培養器材を活用したオープンイノベーションによる先端シーズ及び技術の開発に取り組む。また、今後の日本における法規制の整備によって生じる新しい事業機会(例:早期承認制度、細胞加工受託業)への戦略的参入も検討している。
「財務基盤」
収支バランスを改善し、持続的成長を支え得る「財務基盤」を確立する。具体的には、事業提携、公的助成・補助、エクイティ・ファイナンスを含めた金融的手法など多様な手段を活用して強固な財務基盤を確立し、第1・第2の柱の推進に必要な資金の調達及び安定的資金源の開発に取り組む。また、費用対効果向上を通じた継続的な支出抑制にも取り組む。
 事業提携の獲得による収益獲得・先行投資負担の軽減を目指す
13/12期は既に受領しているエマウス社からの契約一時金150万米ドルを売上計上する計画で、13/12期から14/12期にかけては事業提携の実現による提携一時金850百万円の獲得も見込める。また、研究開発資金として公的助成金・補助金の獲得にも取り組んでいく考え。一方、現在交渉中の事業提携先との協働による「細胞シート再生医療第1号製品の早期事業化」を目指した研究開発投資や中長期的企業価値成長を目指した戦略分野への先行投資が発生する見込みで、上記の数値目標に織り込んだ。
※ 販売承認申請の取り下げを含めた欧州角膜再生上皮シート開発・事業化計画の再編成について
(1)経緯 ①11年5月に欧州医薬品庁(EMA)宛に販売承認申請を提出
同社は100%子会社であるCellSeed Europe Ltd. (セルシード・ヨーロッパ社、本社英国ロンドン)を通じて11年5月に欧州医薬品庁(EMA)宛に販売承認申請を提出し、同年6月から同社申請に関するEMAの薬事審査が開始された。
②評価報告書による多施設共同治験データの要求
審査は薬事審査のスケジュールガイドラインに沿って進められ、同社は12年12月にDay 120評価報告書(EMAが審査スケジュール120日目に申請者に対して送付する評価報告書)に対する回答書を提出した。13年2月にはEMA先進治療委員会(CAT)からDay 150評価報告書(EMAが審査スケジュール150日目に申請者に対して送付する評価報告書)を受領したが、このDay 150評価報告書には、販売承認を取得するためには追加データ類の提出が必要である旨の見解が示されており、追加データには相応の費用と時間が必要となる多施設共同治験のデータが含まれていた。
③日本における公的施策の具体化を踏まえての欧州角膜再生上皮シート開発・事業化の再検討
同社は角膜再生上皮シートの科学的な安全性・有効性に問題はないと考えており、EMAも上述の各評価報告書において角膜再生上皮シートの科学的な安全性・有効性を否定している訳ではない。また、同社は費用と時間を投下して必要データ類を整えればEMAの要求を満たし得る回答書を準備する事が可能であると考えている。しかしその一方で、再生医療を取り巻く環境はここにきて急速に変化しており、特に日本においては、早期承認制度など再生医療の産業化を促進・振興するための様々な公的施策が具体的に検討されている状況である。同社は、こうした環境変化を踏まえて、資金的・時間的投資対効果の観点から従来の計画に基づく欧州角膜再生上皮シート開発・事業化の位置付けを改めて検討し直した。
(2)販売承認申請の取り下げと欧州における角膜再生上皮シートの開発・事業計画の再編
上記経緯の下で検討した結果、販売承認申請を一旦取り下げると共に欧州における角膜再生上皮シートの開発・事業計画を再編成する事が中長期的利益に適うと判断し、その旨、13年3月14日の取締役会で決議した。
|
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




