ブリッジレポート:(7776)セルシード vol.13
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
長谷川 幸雄 |
||
所在地 |
東京都新宿区原町3-61 桂ビル4F |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2012年12月 | 75 | -846 | -842 | -913 |
| 2011年12月 | 86 | -1,418 | -1,358 | -1,442 |
| 2010年12月 | 66 | -1,204 | -1,002 | -1,009 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(12/6現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
【事業内容】
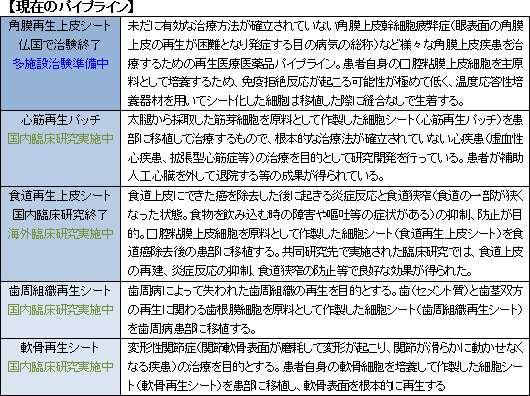
事業は、各種用途向けに様々な種類の細胞シートを開発・製造・販売する「細胞シート再生医療事業」と、細胞シートの培養器材である温度応答性細胞培養器材及びその応用製品の開発・製造・販売を行う「再生医療支援事業」とに分かれる。「細胞シート再生医療事業」では、現在、共同研究先と5つの再生医療医薬品パイプライン(新薬候補)の研究開発を進めており、「再生医療支援事業」では、細胞シート再生医療の基盤ツールである温度応答性細胞培養器材(世界で唯一当社が製造)及びその応用製品を開発・製造(多額の設備投資を必要とする一部の工程は外部委託)し、世界各国の大学・研究機関等に提供している。「再生医療支援事業」は細胞シート再生医療事業の提携先開拓のための戦略的な意義も有している。
 【細胞シートの特徴】
細胞シートは、生体組織・臓器の基本単位であり、「細胞外マトリックス」を保持しているため、縫合等の処置をする事無く患部に移植する事ができる。また、積層化が可能なため、3次元組織・臓器を構築できる可能性もある。
 温度応答性細胞培養器材「UpCell」
細胞シートは、世界で同社だけが製造している細胞シート回収用温度応答性細胞培養器材(製品名:「UpCell」)を用いて作製する。「UpCell」は東京女子医科大学の岡野光夫教授が考案し、同社がそのコンセプトを製品化したもので、「温度応答性ポリマー」の一種であるポリ-N-イソプロピルアクリルアミド(PIPAAm)が使われている。「温度応答性ポリマー」とは、温度によって分子構造を変える性質(温度応答性)を持つポリマーの総称である。PIPAAmを器材(シャーレ)表面にナノテクノロジーを駆使して共有結合で固定すると、培養器材表面は32℃以上で細胞が付着できる適度な疎水性(水分を弾く性質)になり、32℃以下では細胞が付着できない親水性(水分を含む性質)になる。
細胞が有機的に結合した組織を回収する事が可能
一般に細胞は接着蛋白質(「細胞外マトリックス(後述)」)を分泌し自らを固定する事で増殖する。言い換えると、接着蛋白質を分泌して自らをどこかに固定しないと増殖できないのだが、従来の培養方法では、培養した細胞をトリプシン等の蛋白質分解酵素を用いて接着蛋白質を分解して回収していた(それ以外に培養細胞の回収方法が無かった)。このため、酵素処理によりバラバラになった細胞しか回収できず、細胞が有機的に結合した組織を回収する事ができなかった。一方、「UpCell」を用いた温度処理回収の場合、細胞をシート状かつ細胞外マトリックス等を保持した状態で回収できるため、患部定着率が高く増殖が容易だ(バラバラの細胞も接着蛋白質を分泌するため時間の経過と共に定着し細胞同士が結合するが、患部へ定着するとは限らない)。尚、細胞外マトリクスとは、細胞の外に存在する超分子構造体。細胞外の空間を充填すると共に、骨格的役割や細胞間結合の足場的役割を担う他、細胞の増殖・分化も制御する。このため、細胞を細胞として機能させるために不可欠な物質と言う事ができる。 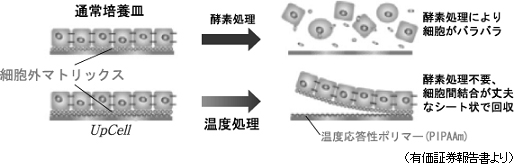 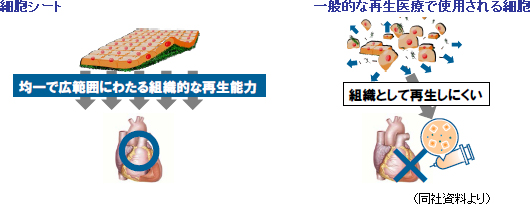 【中期経営計画(13/12期~15/12期)】
「日本の再生医療は、現在、産業化に向けたステージにあり、今後、本格的な成長加速期を迎える」と言うのが同社の考え。このため、現在進行中の「中期経営計画(13/12期~15/12期)」では、従来からの戦略が大きく組み換えられた。具体的には、「外部環境の変化を活用した新たな持続的成長モデルの構築」と言うビジョンの下、「細胞シート再生医療の産業化」、言い換えると、「細胞シートの作製・加工ビジネスの育成」に向けた取り組みが、「事業提携」、「戦略投資」、及び「財務基盤」の面から示されている。
 (1)事業提携:事業提携による細胞シート再生医療第1号製品の早期事業化
細胞シート再生医療の産業化に向け克服すべき課題は、“産業化「出口」の確立”、“生産ブレークスルー(技術開発+インフラ整備)”、及び“Innovativeな研究成果の製品化・事業化”の3つ。いずれの課題についても、Innovationを創出している「大学」、製品化ノウハウを蓄積している「先進ベンチャー」、産業化資源を蓄積している「大手企業」等とAllianceを組成して取り組んでいく考え。
角膜再生上皮シートにかかる事業展開
国内での展開
経済産業省が公募した平成25年度「再生医療等産業化促進事業」に、同社が申請した①「世界標準化に向けた角膜再生上皮シート再生医療製品の有効性評価手法」の検証、及び②細胞シート再生医療製品の製造コストの削減及び品質担保のための品質評価方法の検証が採択された(①及び②の研究について経済産業省から受託したと換言できる)。①については、その成果が、原料細胞が共通する自家食道再生上皮シートに応用する事が可能で、②については、様々なパイプラインの生産自動化(生産コスト低減、品質担保など)に応用する事が可能である。
 海外での展開
提携先のEmmaus Medical(以下、エマウス)社と共同で開発・事業化に取り組んでいる米国での角膜再生上皮シートでは、14年にIND承認(治験開始承認)の取得を目指しており、欧州については、提携による事業化を検討している。尚、欧州での事業は、欧州医薬品庁(EMA)との協議結果及び日本における再生医療産業化環境の急速な整備等を踏まえて、開発・事業化計画の組み直しを進めている。同社は多施設共同治験準備を推進(4ヶ国で治験開始承認を取得)してきたが、資金的な問題からEMAの要請である多施設共同治験データ等の追加提出に応じる事が難しくなった。一方、日本では、昨年後半以降、再生医療産業化環境の整備が急速に進んだ。このため、グローバルな経営資源配分の最適化を図るべく、欧州においては将来の販売承認取得可能性を確保しつつも販売承認申請を一旦取り下げ(3月)、欧州開発・事業化計画を再編成する事とした。
(2)戦略投資:中長期的な企業価値成長を目指した「戦略分野への先行投資」(「戦略分野」の検討・選定・投資)
上期の特許取得は、新型温度応答性細胞培養器材技術「共培養用器材表面」(欧州、5月発表)、密閉型細胞培養容器による上皮系細胞の新規培養方法(日本、5月発表)、角膜内皮再生シート(韓国、6月発表)、移植用角膜内皮再生シート(韓国、1月発表)、癌組織モデル作製用癌細胞シート(日本、6月発表)の5件。また、09年度以降、細胞シートの生産自動化に取組むFIRSTサイエンスフォーラムの岡野教授プロジェクトに参画している。同社が担当しているのは、細胞シートの自動積層化装置でスタンプを利用した積層化技術が応用されている。 (3)財務基盤:収支バランスを改善し持続的成長を支え得る「財務基盤」の確立
成長資金を取り込むべく、9月にUBS AG ロンドン支店を第三者割当先とする第10回新株予約権274個及び第11回新株予約権(行使価額修正条項付)1,400個を発行した。新株予約権と資金調達の概要は次の通り。  |
| 2013年12月期第3四半期決算 |
 売上高91百万円、経常損失327百万円
売上高は前年同期比64.5%増の91百万円。内訳は、再生医療支援事業が74百万円(前年同期比18百万円増)、細胞シート再生医療事業が16百万円(前年同期は売上計上無し)。細胞シート再生医療事業では、欧州における角膜再生上皮シート開発計画見直しに伴いGENESIS Pharma SAとの販売提携契約を解消した事で、契約締結時に受領した一時金16百万円を売上計上した。
 「継続企業の前提に関する注記」の記載解消
前期末の手元資金(現預金)残高が239百万円に減少し、想定される年間必要資金に比して著しく少ない金額となったため、継続企業の前提に関する重要な疑義を生じさせる状況となった。
|
| 2013年12月期業績予想 |
 通期業績予想に変更はなく、売上高530百万円、経常損失215百万円
前受金として計上していた受領済みのエマウス社からの契約一時金150万米ドルを売上高へ振り替える他、新たな提携に係る一時金収入も見込まれ、細胞シート再生医療事業において460百万円の売上を計上できる見込み。一方、再生医療支援事業は、前期実績(75百万円)をわずかに下回る70百万円を想定していたが、第3四半期累計で74百万円を計上している。
|
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




