ブリッジレポート:(7776)セルシード vol.15
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
橋本 せつ子 |
||
所在地 |
東京都新宿区原町3-61 桂ビル4F |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2013年12月 | 105 | -534 | -581 | -584 |
| 2012年12月 | 75 | -846 | -842 | -913 |
| 2011年12月 | 86 | -1,418 | -1,358 | -1,442 |
| 2010年12月 | 66 | -1,204 | -1,002 | -1,009 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(5/30現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
【事業内容】
事業は、各種用途向けに様々な種類の細胞シートを開発・製造・販売する「細胞シート再生医療事業」と、細胞シートの培養器材である温度応答性細胞培養器材及びその応用製品の開発・製造・販売を行う「再生医療支援事業」とに分かれる。「細胞シート再生医療事業」では、共同研究先と複数の再生医療医薬品パイプライン(新薬候補)の研究開発を進めている。
・米国角膜再生上皮シート :動物実験が終了し、バイオロジックス(生物学
的製剤)としての認定受領 ・心筋再生パッチ :ヒト骨格筋芽細胞シートの実用化でテルモ社と 基本合意(12年3月発表) ・食道再生上皮シート :共同研究先での臨床研究が終了し良好な結果が 得られた (12年8月発表)他、海外の共同研究 先が臨床研究の準備を進めている。 【同社技術基盤の優位性】
現在、「細胞シート工学」だけが唯一「ヒト細胞のみからの組織の人工作製」という課題を原理的に解決しており、また、角膜再生上皮シート、食道再生シート、心筋再生パッチ、歯周組織再生シート・軟骨再生シートといった様に「細胞シート再生医療」の科学的なProof of Concept が多様な組織・疾患のヒト臨床で示されている。加えて、上市済み再生医療製品の殆どは皮膚と軟骨であり、上記の通り細胞シート再生医療の応用面での多様性は類を見ない。
【事業環境】
再生医療の産業化を取り巻く環境は追い風を受けており、特に安倍政権下で法整備が進んだ日本は再生医療事業環境の活性化が顕著である。例えば、13年4月には再生医療の実用化を目指した再生医療推進法が成立し、同年11月には改正薬事法(いわゆる医薬品医療機器等法)と再生医療等安全性確保法が成立した。医薬品医療機器等法においては、医薬品や医療機器とは別に「再生医療等製品」が新たに定義され、その特性を踏まえた制度(例:条件及び期限付承認制度、いわゆる早期承認制度)が導入された。また、再生医療等安全性確保法においては、再生医療を3つのカテゴリーに分類して安全性確保を図るリスク別安全性規制が導入された他、細胞加工業(特定細胞加工物の製造を外部委託できる仕組み)が新たに創設される事となった。
|
| 中期経営計画と2014年12月期の取り組み |
|
・ 再生医療推進基本法(昨年4月成立) ・ 改正薬事法(早期承認制度等、昨年11月成立) ・ 再生医療等安全性確保法(加工業等、昨年11月成立) この他、研究開発向け公的補助・助成の拡充や市場創出へ向けた支援に加え、世界で初めてiPS細胞ヒト臨床研究も承認された(7月、網膜治療)。 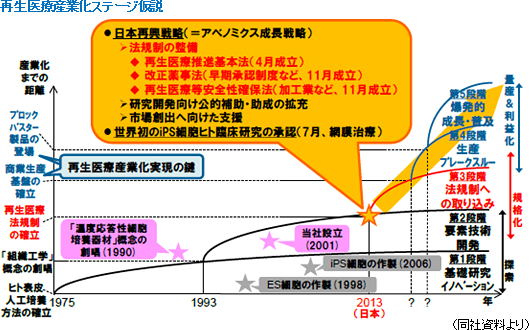 「再生医療産業化」実現のキーワードは3つの”A”(Automation、Allogeneic、Alliance)
再生医療産業化ステージ仮説に基づく今後のキードライバーは、「商業生産基盤の確立」と「ブロックバスター製品の登場」。「商業生産基盤の確立」には、生産コストの抜本的低減、生産能力の飛躍的増強、及び製品品質の向上・均一化が必要不可欠であり、「ブロックバスター製品の登場」のためには、大型市場(例:1,000億円以上/年)の戦略的ターゲティング、オープンイノベーションの活用による差別化&技術課題の解決、及び製品特性に合致した充分量のマーケティング先行投資の投下が必須。また、共に、Automation(生産システムの自動化)、Allogeneic(他家細胞原料化の実現)、Alliance(産学連携・事業提携による取り組み)がキーワードとなる。
細胞シート工学は「ヒト細胞のみからの組織の人工作製」という課題を原理的に解決した画期的技術
再生医療のプロセスは、最適な細胞の選択・確保 → 組織の作製 → 組織の大きさ・形・厚みのコントロール → 臓器の作製。細胞シート工学は、このプロセスのうち、組織の作製、組織の大きさ・形・厚みのコントロール、及び臓器の作製にアプローチできる技術である。組織の作製プロセスでは、細胞シート工学は 「ヒト細胞のみから様々な種類の組織を人工作製する」という課題を原理的に解決しており、組織の大きさ・形・厚みのコントロールでは、細胞シート工学はこの課題を解決する原理(積層化+血管導入)を非臨床研究で示す事に成功している。一方、臓器の作製は組織作製が出来て初めて取り組む事ができる課題である。
【中期経営計画の概要(14/12期~16/12期)】
「細胞シート工学」という日本発の革新的再生医療技術を基盤として様々な「細胞シート再生医療」製品を開発し、その世界普及を推進するためには細胞シート再生医療第1号製品を早期に上市する必要がある。同社は産学連携や事業提携を通じて自家再生医療の実現を図る考えで、事業化に至る先行投資負担の軽減、機能、スキル、技術など同社が比較優位を持たない経営資源を補完していく。また、再生医療の本格産業化(他家原料+生産自動化)に向け、他家再生医療の実現にも取り組む。
(1)再生医療本格産業化へのロードマップ :日本で開発した 「再生医療産業化パッケージ」で世界市場の開拓を目指す (2)中期経営計画(14/12期~16/12期)
概要 :13年2月に発表した中期経営計画の「3つの柱」を拡充
「外部環境の変化を活用した新たな持続的成長モデルの構築」という中期的ビジョンの下、3つの柱を推進する。
第1の柱 「事業提携」の実現により、細胞シート再生医療第1号製品の早期事業化を図る
第2の柱 中長期的な企業価値成長を目指した「戦略分野への先行投資」を行う 第3の柱 収支バランスを改善し、持続的成長を支え得る「財務基盤」を確立する 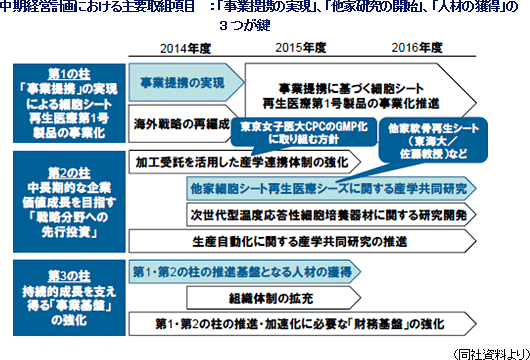  ・現在推進中の事業提携交渉における条件交渉の阻害要因となる可能性 ・研究開発費に関する不確定要素(事業提携の内容に応じて研究開発活動計画が変わる可能性) 尚、上記の再生医療支援事業の予想では、再生医療関連研究開発需要の高まりを受けて、16/12期以降の増収率が年率5%程度で推移すると考えている。 (3)第三者割当による第1回無担保転換社債型新株予約権付社債及び第12回新株予約権の発行による資金調達
第三者割当による第1回無担保転換社債型新株予約権付社債(以下、転換社債)及び第12回新株予約権(以下、新株予約権)の発行により資金調達を行う。この資金調達を通じて戦略的テーマに関する中長期的研究開発活動を加速する事で中長期的な企業価値向上を図る。調達額の総額は新株予約権の将来的な行使による概算調達額2,277百万円を含めた2,786百万円。内訳は、第1回無担保転換社債型新株予約権付社債の発行による調達500百万円、第12回新株予約権の発行による調達9百万円、及び将来的な行使による概算調達額2,277百万円。具体的な調達資金の使途は、他家軟骨細胞シートの研究開発を中心とした「戦略投資」資金、研究開発組織体制の強化に必要な人件費、細胞シート再生医療第1号製品の事業化推進資金、及び運転資金への充当。 第1回無担保転換社債型新株予約権付社債
発行価額総額 500百万円転換価格 1,294円 償還期限 2018年3月20日 第12回新株予約権
発行総額 9,328千円発行価額新株予約権 1個につき26,500円(新株予約権の目的となる株式1株 当たり5.30円) 行使価額 1,294円 新株予約権の総数 352個 行使期間 2014年3月20日から2018年3月19日。 ウィズ・ヘルスケアPE1号投資事業有限責任組合の概要と保有方針
ウィズ・ヘルスケアPE1号投資事業有限責任組合は、同ファンドの業務執行組合員であるウィズ・パートナーズが創設したファンドで、純投資を目的としている。また、ウィズ・パートナーズは、日本におけるバイオベンチャー黎明期である1999年にバイオ・ヘルスケア分野への投資を本格的に開始し、以来、国内外(日本、米国、ドイツ、フランス、イスラエル、韓国等)のバイオ・ヘルスケア分野の投資先30社程度への投資実績を有する。ウィズ・ヘルスケアPE1号投資事業有限責任組合は、今回取得した(株)セルシード株式について、原則として中長期保有する意思を有しておらず、市場動向、投資家の需要、提携先の意向等を勘案しながら売却する方針。もっとも、単なる投資の回収を目的として新株式を市場で売却するのではなく、(株)セルシードと事業上のシナジー効果が見込まれる先、或いは安定株主となり得る先への譲渡を可能な限り模索し、資本構成の最適化を通じて、株式市場における評価を高めていく考え。また、ウィズ・パートナーズを通して製薬企業等との業務提携等、(株)セルシードの企業価値向上に資する施策の支援も受ける予定。 ただ、ウィズ・ヘルスケアPE1号投資事業有限責任組合は、出資者に対する運用責任を遂行する立場から、市場への影響に十分配慮しつつ、インサイダー取引規制なども考慮した上で、保有株式を市場で売却する可能性はある。 |
| 2014年12月期第1四半期決算 |
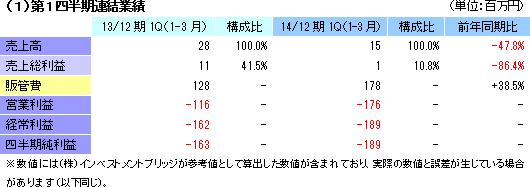 売上高15百万円(前年同期は28百万円)、営業損失1億76百万円(同1億16百万円)
細胞シート再生医療事業での売上計上はなく、再生医療支援事業において15百万円の売上を計上した。大口先からの受注が、前期は第1四半期にあったが、今期は第2四半期以降になる見込み。利益面では、売上が減少する中、研究開発費(54百万円→81百万円)を中心に販管費が増加したため、前年同期は1億16百万円だった営業損失が1億76百万円に拡大した。営業外損益の改善は、為替差損や支払手数料の減少による。 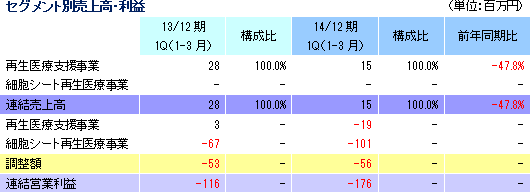  (3)細胞培養器材製造委託基本契約の締結
2014年4月15日、同社は今後の本格的な再生医療の展開に対応するため、温度応答性細胞培養器材製品を中心とした細胞培養器材製品の品質や生産能力を維持しつつ安定供給を推進するべく、大日本印刷(株)と細胞培養器材製品の器材製造委託基本契約を締結した。同社は、再生医療産業化に資する新規の温度応答性細胞培養器材や関連製品の開発に注力し、更なる品質の向上やコスト削減、量産プロセスの構築に取り組むと共に、同社の製造ノウハウと大日本印刷(株)がこれまで培ってきた印刷技術等を融合する事で、再生医療支援製品の普及と市場への浸透に努めていく考え。 |
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




