ブリッジレポート:(7776)セルシード vol.25
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
橋本 せつ子 |
||
所在地 |
東京都江東区青海二丁目5番10号 テレコムセンタービル |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2015年12月 | 193 | -568 | -531 | -535 |
| 2014年12月 | 86 | -601 | -577 | -582 |
| 2013年12月 | 105 | -534 | -581 | -584 |
| 2012年12月 | 75 | -846 | -842 | -913 |
| 2011年12月 | 86 | -1,418 | -1,358 | -1,442 |
| 2010年12月 | 66 | -1,204 | -1,002 | -1,009 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(12/16現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
【セルシードを理解するためのポイント】
ポイント1:細胞シート工学の優位性
「細胞シート工学」は、日本発・世界初の再生医療のプラットフォーム技術である。再生医療では培養された細胞が使われるが、従来の技術では、細胞の培養はできても、培養された細胞を無傷で回収する事ができなかった。これに対して、「細胞シート工学」は培養した細胞を無傷の状態で回収できる画期的な技術である。ポイントは、温度で性質が変わる温度応答性ポリマーで表面を加工した細胞培養皿で細胞を培養する事。温度応答性ポリマーは培養時の37℃(体温と同じ)では疎水性を示すが、20℃に温度を下げると親水性に変わり、親水性に変わると表面に付着した細胞が自然に剥がれる(温度を下げるだけで、無傷の状態で回収できる)。
・温度応答性ポリマーで表面を加工した細胞培養皿で細胞を培養
・温度を変えるだけで、細胞外マトリックスを保持したまま有機的に結合した「細胞シート」を培養皿から回収できる。 一方、「細胞シート工学」は、細胞外マトリックスを保持したまま有機的に結合した「細胞シート」を培養皿から回収する事ができる。 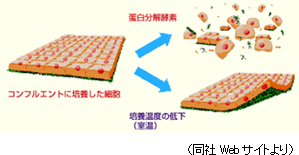
温度応答性細胞培養器材は温度を下げると、温度応答性ポリマーの性質が変わり、細胞シートが剥離するため、細胞外マトリックスを破壊する事無く回収できる。
一方、従来のように細胞の回収に際してトリプシン等のタンパク質加水分解酵素を用いると、タンパク質加水分解酵素が細胞間の結合因子や接着因子を破壊し、細胞に大きな傷害を与えてしまう。 ポイント2:体性幹細胞を用いるセルシードの再生医療製品
再生医療応用の鍵と位置付けられているのが幹細胞である。幹細胞とは、様々な細胞に分化できる細胞で、再生医療を応用するにあたって鍵となる細胞である。幹細胞には、ES細胞、iPS細胞、体性幹細胞があり、ES細胞は受精卵から作られ、全ての細胞に分化する事ができるが、受精卵とは「ヒト」そのものであるため、その利用には倫理的な問題がある。iPS細胞は、既に分化した細胞に4つの遺伝子を導入した人工多能性細胞だが、安全性等の面で解決されていない課題が残っている。一方、体性幹細胞は生体のさまざまな組織(分化した細胞)にある幹細胞である。 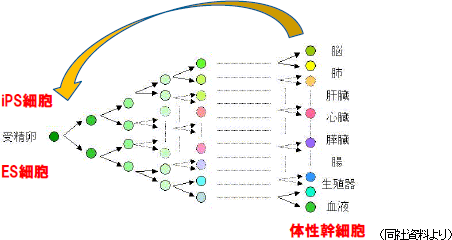 再生医療実現に向けた戦略は各社各様
<どの細胞を使うか?>自己細胞(自家細胞) 同種細胞(他家細胞) ES細胞 :受精卵から作られ、すべての細胞に分化することができる多能性細胞 PS細胞 :分化した細胞に遺伝子を導入した人工多能性細胞 体性幹細胞 :生体のさまざまな組織にある幹細胞 ・細胞の懸濁液を血管に通して投与する(細胞療法) ・足場に細胞を生着させて移植する(スキャッフォールド) ・組織に似た細胞シートを作成して移植する(細胞シート工学) 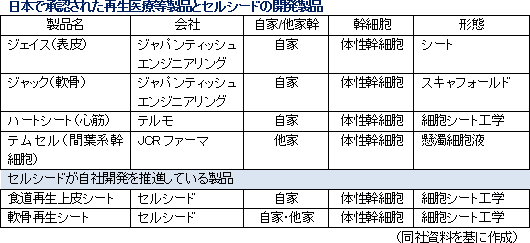 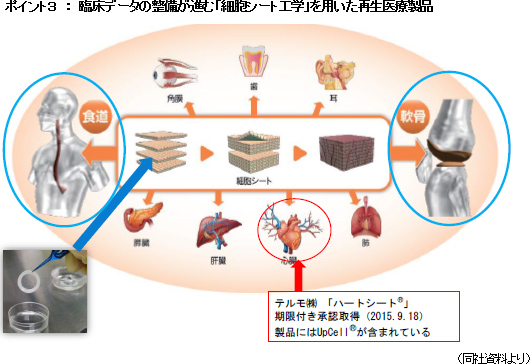 尚、2015年9月には、(株)セルシードの温度応答性細胞培養器材「アップセル」が組み込まれているテルモ製「ハートシート」(心臓の再生医療に用いる)が期限付き承認を取得した。(株)セルシードは2016年3月末にテルモ(株)との間で「細胞培養器材に関する取引基本契約」を締結しており、「ハートシート」専用(特注品)の温度応答性細胞培養器材「アップセル」の供給責任を負っている。期限付き承認とは、医薬品医療機器等法による「早期承認制度」に基づくもので、有効性や安全性の短期間での評価を可能にする一方、市販後も有効性や安全性の更なる検証を行い、5年以内に再度承認申請を行う事が義務付けられている。 「ハートシート」は、大腿部からヒト骨格筋筋芽細胞を採取する時に使用する機器(キットA)と細胞シート培養器材「アップセル」を含む細胞をシート状に培養する際に使用する機器(キットB)に分かれ、保険償還価格(薬価)はキットAが6,360千円、キットBが1,680千円。治療にはキットBが5つ必要となるため、キットAとキットB5つで総額14,760千円(保険が適用されるため患者負担は月数万円)。「ハートシート」は承認からわずか2カ月後の2016年1月に薬価基準が収載される等、承認後の当局の対応の早さも話題になった。 ポイント4:再生医療等製品の早期実用化に向けた制度の導入
2014年11月25日に医薬品医療機器等法(薬事法が改正・名称変更された)と再生医療等安全性確保法が施行され、前者において早期承認制度が導入され、後者において細胞培養加工の外部委託が認められた。早期承認制度が導入された事は、同社にとって、「食道再生上皮シート」や「軟骨再生シート」等、再生医療パイプラインの早期の収益化に向けた道が開かれた事を意味する。また、後者によって、温度応答性細胞培養器材と、これまでに蓄積してきた細胞培養技術を活かす事ができる細胞培養加工の受託ビジネスの芽も出てきた。
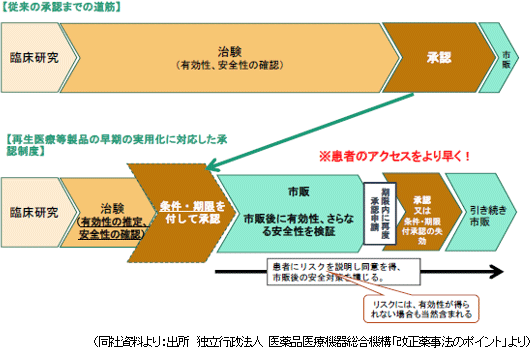
医薬品医療機器等法による「早期承認制度」
ヒトの細胞を用いる再生医療等製品は個人差を反映して品質が不均一となるため、従来の承認制度の下では有効性を確認するためのデータの収集・評価に時間を要していた。しかし、早期承認制度(条件・期限付き承認)が導入された事で、有効性については、一定数の限られた症例から有効性を推定できるようになり、安全性についても、急性期の副作用等は短期間で評価を行う事が可能になった。
 |
| 中期経営計画(16/12期~18/12期)と進捗状況 |
 また、台湾の上場企業である三顧股份有限公司(MetaTech (AP)Inc.)(本社:台湾 新北市、代表者 胡立三)との台湾での細胞シート再生医療事業の導出へ向けた協議を開始した。今後17年3月までに台湾での細胞シート再生医療事業(食道再生上皮シート・軟骨再生シート)の開発・製造・販売権を譲渡することを前提とした協議を進めていく予定。 (1)再生医療製品の早期収益化
食道再生上皮シート
食道がん再生治療法(食道創傷治癒・狭窄予防)として東京女子医大先端研が開発した治療法である。患者から採取した口腔粘膜から細胞を取り出し、取り出した細胞を同社の細胞培養施設CPCに持ち込み、温度応答性培養器材を用いて約2週間かけて細胞を培養し、細胞シートを作成する。細胞シートの培養に合わせて、食道がん切除内視鏡手術を行い、食道潰瘍面に移植する。2008年から2014年にかけて大学で臨床研究が行われ、東京女子医科大学10症例、東京女子医科大学・長崎大10症例(長距離輸送検証:長崎大で採取した細胞を東京女子医大で培養し、長崎大で移植手術)、カロリンスカ大学病院(スウェーデン)10症例、の計30症例が既にあり、同社は、東京女子医科大学と開発基本合意契約を締結して同大学の研究成果を引き継いだ。 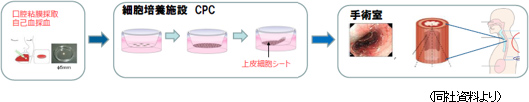 ・年間約22,000人が食道がんと診断され、年間約11,500人が食道がんで死亡 ・男性の発症率、死亡率は女性の5倍 ・日本では食道がんの90%が扁平上皮がん ・5年生存率は男性36%、女性44%と低い 治療法として、2008年に保険収載された内視鏡切除手術(ESD)が増加しているが、ESDは手術後の食道狭窄の副作用がある。早期発見、内視鏡手術、食道再生上皮シートの導入により、食道がんを治せるがんにする事が同社のミッションである。 2016年4月の治験届を経て、2016年8月に国立がん研究センター(中央病院、東病院の2施設)及び東京女子医大において治験を開始した。フェーズ3相当の治験を9症例で実施する計画で、米国国立衛生研究所 (NIH) が運営する登録システム「ClinicalTrial.gov」に治験情報が掲示されている。また、海外では、スウェーデンでの企業治験を計画しており、その推進役となる子会社CellSeed Sweden AB(スウェーデン)を2015年5月に設立し、2015年11月30日にはスウェーデン医薬品庁(MPA)に事前相談を行った。欧州全体での承認を目指して、欧州医薬品庁(EMA)との事前相談に向けた準備も進めている。 細胞シート移植用デバイスも同時に開発 「食道再生上皮シート」は移植作業に高度な技術を要するため、作業負担の軽減につながる細胞シート移植用デバイスも開発した。日本では「食道再生上皮シート」とのコンビネーション製品として販売承認を取得するが(細胞シートと組み合わせて治験を実施)、欧州では医療機器としての販売承認が必要なため、CEマーク(欧州での医療機器としての承認)の取得に向けた作業を進めている。   軟骨再生シート
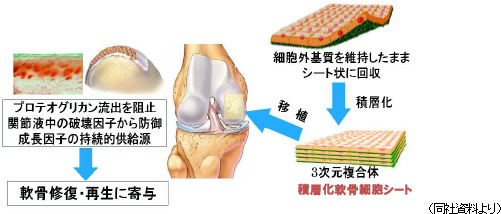
軟骨再生シートは、東海大学整形外科佐藤正人教授との共同研究であり、スポーツによる損傷や加齢を原因とする軟骨欠損や変形性関節症を適応症とする(潜在患者は1,200万人とも言われている)。いずれも、現在、根治する方法がないが、共同研究は自己細胞シートによる8症例の臨床研究の実績を有する。軟骨細胞を培養して作製した細胞シート(3枚重ねた積層化軟骨再生シート)を患部に移植し、軟骨表面を根本的に再生する。既にPMDAとの事前相談が始まっており、PMDAからアドバイスを受けているが、更に相談を重ね、安全性データの蓄積と臨床プロトコルの確立に取り組んでいく。尚、膝の軟骨は、硝子(しょうし)軟骨と言い、耳や鼻等の軟骨とは異なり、クッション性と対摩耗性に優れた硬い軟骨だ。同社の軟骨再生シートは、再生が難しい硝子軟骨として膝の軟骨を再生できる事が特徴である。
 角膜再生上皮シート
2016年6月15日に米国Emmaus Medical Inc.(以下、エマウスメディカル社)との間で、米国角膜再生上皮シート事業関連の特許実施許諾契約を締結した。同社は、2011年4月にエマウスメディカル社との間で「米国における角膜再生上皮シート共同開発・事業化契約」及び「共同研究開発基本契約」を締結して、角膜再生上皮シートに係る技術移転を進めると共に開発データを提供した。技術移転及び開発データの提供が一巡した事を受けて2015年12月に両契約は終結したが、その後もライセンスアウトを前提にエマウスメディカル社を含めた関係各所と協議を続けてきた。今回の契約に基づき、エマウスメディカル社は米国での角膜再生上皮シート開発を推進し、エマウスメディカル社が米国で角膜再生上皮シートに係る売上を計上した際には、(株)セルシードがロイヤルティ収入を受領する事となった。
(2)再生医療支援事業を拡充し、収益機会を拡大
既存製品の応用範囲の拡大や新製品の開発を進め収益機会を拡大させると共に、営業手法を多様化していく(営業戦略の拡充)。現在、温度応答性細胞培養器材として、「アップセル」、「レプセル」、及び超低付着性細胞培養器材「ハイドロセル」という3製品を有するが、新規アプリケーションの開発や研究用器材の新製品開発を進め収益機会を拡大させていく。営業手法の多様化では、国内外の販売網を強化する他、販売後の技術サポートを充実させる事で新しい研究への応用を支援すると共に、より使いやすい製品等、新製品の開発につなげていく。また、展示会やセミナーを開催して説明機会を増やし、認知度の向上を図る。
(3)国内・海外の組織体制
国内では、本社をテレコムセンタービル15階(東京都江東区青海)に移転し、2016年1月より新本社で業務を開始した。また、同ビルの6階では自社細胞培養施設(延床面積約763 ㎡、CPC4ライン)の整備が進められている。欧州では、食道再生上皮シートの欧州での開発に向け、2015年5月にCellSeed Sweden ABを設立した。  (4)資金調達の状況
自社細胞培養施設の準備・運営資金、再生医療支援事業関連仕入、及び国内外での業務推進のための運転資金確保を目的に、2015年8月31日、第三者割当方式により新株予約権を発行した。また、公的助成金・補助金等の活用についても引き続き検討していく。
第13回新株予約権
|
| 2016年12月期第3四半期決算 |
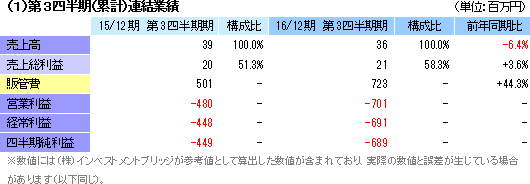 8月に食道再生上皮シートに係る国内での治験を開始
再生医療支援事業において、温度応答性細胞培養器材を中心とした器材販売に伴う売上36百万円を計上した。一方、細胞シート再生医療製品パイプラインの自社開発を中心とした研究開発に取り組んでいる細胞シート再生医療事業は売上計上がなかったが、この8月に、国立がん研究センター中央病院、国立がん研究センター東病院、東京女子医科大学病院の3医療機関を治験実施医療機関とする「食道再生上皮シート」の国内治験を開始した。販管費は細胞シート再生医療事業での研究開発費を中心に7億23百万円と前年同期比44.3%増加した。内訳は、研究開発費3億93百万円(前年同期2億円)、その他3億29百万円(同3億円)。再生医療支援事業も、ラインナップの拡充に向けた新規器材の研究開発で先行投資が続いている。 尚、同社はNEDOから「立体造形による機能的な生体組織製造技術の開発」プロジェクトを受託しており(2014年11 月7日発表)、同プロジェクトの2015年度分完了に伴う補助金収入9百万円を営業外収益に計上した。 ※ NEDO(New Energy and Industrial Technology Development Organization):新エネルギー・産業技術総合開発機構  |
|
| <参考:コーポレートガバナンスについて> |
 ◎コーポレートガバナンス報告書 更新日:2016年04月01日
基本的な考え方
当社は、技術革新と創造性を発揮し、質の高い優れた製品とサービスの提供を通じ人々の健康と福祉に貢献していくことを使命とし、全ての企業活動において品質を高めるべく企業統治の整備を進めています。今後につきましては、ディスクロージャーの透明性を高めるため一層説明責任を充実するとともに、さらなる経営のチェック機能強化を図ってまいります。 |
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




