【基本方針】
・食道再生上皮シートの製造販売承認申請
・軟骨再生シートの治験開始に向けた開発加速
・次期品目の開発着手
・組織体制・インフラの構築
・再生医療支援製品の新製品開発及び収益機会獲得
・世界展開に向けた事業提携推進
食道再生上皮シートについては、早期の製造販売承認申請を目指し、軟骨再生シートについては、自己軟骨再生シートの治験準備を進めると共に同種(他家)軟骨再生シートの開発を加速する。また、食道再生上皮シート及び軟骨再生シートに続く次期品目の開発に着手すると共に、組織体制・インフラの構築にも取り組む。再生医療支援事業では再生医療支援製品の新製品開発を推進すると共に受託事業で更なる収益機会の獲得を目指す。日本発の細胞シート工学の世界展開のために海外企業との事業提携も積極的に進めていく。
【中期経営計画の達成に向けた取り組み】
食道再生上皮シートの製造販売承認申請
同社の説明によると、日本では、年間約22,000人が食道がんと診断され(日本では食道がんの90%が扁平上皮がん)、年間約11,500人が食道がんで死亡している。男性の発症率・死亡率は女性の5倍で、5年後の生存率は男性36%、女性44%、と男女共に低い。治療法として、2008年に保険収載された内視鏡切除手術(ESD)が増加しているが、ESDは手術後の食道狭窄の副作用がある。食道再生上皮シートの導入により、食道狭窄の生じる頻度を抑制してQOLの向上を目的としている。
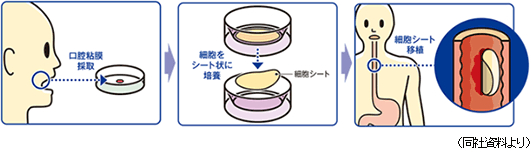
「食道再生上皮シート」による治療は、食道がん再生治療法(食道創傷治癒・狭窄予防)として東京女子医大先端研が開発した治療法である。患者の口腔粘膜から採取した細胞を温度応答性培養器材で約2週間かけて培養し、細胞シートを作成する。細胞シートの培養に合わせて、食道がん切除内視鏡手術を行い、食道潰瘍面に移植する。
2008年から2014年にかけて大学で臨床研究が行われ、東京女子医科大学10症例、東京女子医科大学・長崎大10症例(長距離輸送検証:長崎大で採取した細胞を東京女子医大で培養し、長崎大で移植手術)、カロリンスカ大学病院(スウェーデン)10症例、の計30症例が既にあり、同社は、東京女子医科大学と開発基本合意契約を締結して同大学の研究成果を実業化に向けて引き継いだ。
国内では、16/12期第2四半期(4月)の治験届を経て、同第3四半期(8月)に国立がん研究センター(中央病院、東病院の2施設)及び東京女子医大において治験を開始した。18/12期第2四半期に症例登録を終了し、19/12期第1四半期に治験を終了した。
海外では、子会社CellSeed Sweden AB(スウェーデン)を15/12期第2四半期(5月)に設立し、同第4四半期(11月)にはスウェーデン医薬品庁(MPA)に事前相談を行った。また、17/12期第1四半期(4月)に台湾のMetaTech社と事業提携契約を締結し、同社が2018年12月末に治験届を提出した。
治験結果の概要 有効性についての十分なデータが得られず追加の治験実施へ
治験において、副作用の発生はなく、安全性についての問題は認められなかった。ただ、その一方で、主要評価項目である「ESD(内視鏡的粘膜切除術)後8週目の狭窄予防効果」の有効率(非狭窄率)が12.5%にとどまり、閾値奏効率(ESD後の無処置患者に対する非狭窄率)に対して統計的な優位性が証明されなかった。
同社は、上記治験結果について、データ確定作業と並行して承認機関である独立行政法人医薬品医療機器総合機構(PMDA)との先駆け定期面談の中で協議を進めてきたが、2019年2月にPMDAより、「安全性は確認できたものの、有効性については十分なデータであるとは言い切れず、製造販売承認申請については追加の臨床試験を実施し、有効性を確認するデータの提出が必要である」との回答を受けた。これを受けて同社は追加臨床試験を実施すべく、PMDAと協議を続けていく考え。19/12期中に追加治験の治験届を提出し、21/12期の追加治験終了、22/12期の製造販売承認申請を目指している。
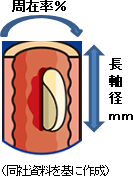
10症例登録し、うち2症例がドロップしたため、最終的に8症例となったが、有効性を確認できたのは1症例にとどまった。治験の選択基準、言い換えると、切除する範囲の基準を、切除周在率75%以上、切除長軸径80mm未満、として治験を実施したが、8症例のうち、この範囲に収まったのは2症例にとどまり、6症例の長軸径が80mm以上と当初設定した選択基準値を実際の手術の際には超える大きさとなった。この辺りが再生医療製品の治験の難しさであると言う。切除範囲が大きくなると、狭窄の発生確率が高くなる。ちなみに、臨床研究と治験合計の選択基準内の有効率は57.1%(14症例中8症例で有効性が確認できた)。
治験開始に向け、軟骨再生シートの開発を加速
東海大学との共同研究
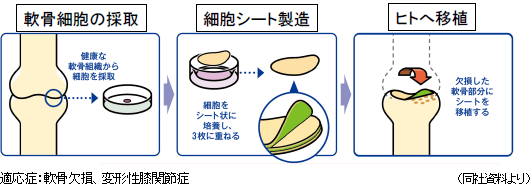
同社は2004年に温度応答性細胞培養皿の提供を開始し、2006年に共同研究を開始した。2010年以降は、同大学で始まった臨床研究を支援し、2014年には同社から研究員を派遣し、共同研究体制を強化した。自己細胞シート移植の臨床研究が2011年8月に第65回厚生科学審議会科学技術部会で承認され、同年10月に厚生労働大臣の意見書(厚生労働省発医政1003第3号)が発出された。同年11月に第1例目臨床研究が始まり、2015年11月に8例の2年後評価が終了した。また、2019年1月には厚生労働省「第71回先進医療会議」において、東海大学医学部付属病院が申請していた「自己細胞シートによる軟骨再生治療が」が先進医療として承認された。同社は軟骨再生シートを受託製造する。
尚、同社と東海大学は、国立研究開発法人日本医療研究開発機構(AMED)が公募した補助事業である平成30年度「再生医療の産業化に向けた評価基盤技術開発事業(再生医療シーズ開発加速支援)を通じて変形性膝関節症治療のための軟骨細胞シートの有効性因子の探索や同種軟骨再生シートの治療に向けた研究開発を共同で進めている他、AMEDの「自己軟骨細胞シートのための統合的評価手法」プロジェクトにも(株)DNAチップ研究所と共に参画している。
 同種細胞シート移植の開発
同種細胞シート移植の開発
同種細胞シート移植についても、2017年2月15日に世界初となる第1例目の臨床研究が行われた(移植手術を実施)。この臨床研究は、多指症患者から軟骨組織を採取し、2~3週間かけて培養した細胞シートを移植するもので(先天的に手の指が6本ある乳児から切除された指の軟骨細胞を同意を得て利用)、今後3年間で10名の患者への移植を計画しており、2020年3月までに移植を終了する予定。並行してセルバンクの構築と細胞シート製造の自動化にも着手した。2021年に企業治験を開始する予定でAMEDから支援を受けている。
再生医療受託サービス
再生医療受託サービスでは、細胞シート製品の製法開発・受託製造、施設管理・申請支援、細胞培養技術者教育等のサービスを提供している。
細胞シート製品の製法開発・受託製造では、細胞シート製品の製造受託や品質試験等を手掛けている。特徴は、日本再生医療学会認定の臨床培養士等、培養の知識・経験豊富なスタッフが多数所属し、特定細胞加工物製造の許可を受けた施設(施設番号:FA3160008)において、同社製品であるUpCellRを用いて細胞シートを作製する事である。AMEDに採択された東京女子医科大学先端生命医学研究所(研究開発担当者 岩田隆紀氏)の再生医療実用化研究事業「同種歯根膜由来間葉系幹細胞シートによる歯周組織の再建」における同種歯根膜由来間葉系幹細胞シートの製造関連業務を2018年11月に受注した。
施設管理・申請支援では、特定細胞加工物の製造の申請資料の作成や申請・届出や文書作成コンサルティング、施設設備・管理体制の維持、管理支援等のサービスを提供しており、細胞培養技術者教育では、細胞シート培養トレーニングや細胞シート剥離トレーニング等のサービスを提供している。
次期開発品目の検討
2020年末までに、食道再生上皮シート(日本)、軟骨再生シート(日本)に次ぐ第3品目目の開発案件を選定して事業化を開始する。具体的な開発品目・地域については研究実施機関との契約等、準備が整い次第着手する。
世界展開に向けた事業提携推進
既存契約先の台湾のMetaTech社の支援を推進する。同社、MetaTech社、と共同で台湾政府の下で、新規研究開発拠点の設立に向けた活動を予定している。また、新規契約の獲得にも取り組む。具体的には、事業提携・ライセンシングに向け、アジア諸国・欧米を中心に活動を継続する(MetaTech社の様に開発中案件に関心を示す交渉先企業はあるものの、18/12期の契約締結はなかった)。開発中パイプラインの開発推進による事業価値向上と並行して、アジア諸国・欧米をターゲットに問う中期経営計画期間中に新規事業提携先の獲得を目指す。
尚、MetaTech社とは2017年4月に事業提携契約を締結し、細胞シート再生医療事業(食道再生上皮シート及び軟骨再生シート)の台湾での独占的な開発・製造・販売権を付与した。(株)セルシードの支援の下で、MetaTech社が台湾での開発・事業化を推進する。
18/12期に開発進捗に応じた技術移転料等9億60百万円を受領した。

再生医療支援事業において、2018年11月に第1号案件を受注した再生医療受託サービスの堅調な推移が見込まれるものの、全社ベースでは、19/12期、20/12期と先行投資が続く見込み。21/12期は、細胞シート再生医療事業において、新たな提携による収益を見込でいる。
(株)セルシード主催イベントフォーラムの開催
第1回細胞シート工学イノベーションフォーラムを2019年7月19日(13:30~18:00)に開催する。会場は東京都立産業技術研究センター、定員150名(事前登録制、先着順、研究者対象)。
講演予定者は、岡野光夫 東京女子医大名誉教授、清水達也東京女子医大先端生命医科学研究所 所長、佐藤正人 東海大学医学部外科学系整形外科学 教授、岩田隆紀 東京医科歯科大学 大学院歯学総合研究科 歯周病学分野 主任教授。
尚、「細胞シート」又は「温度応答性細胞培養器材」を用いた研究のポスター演題を募集している。

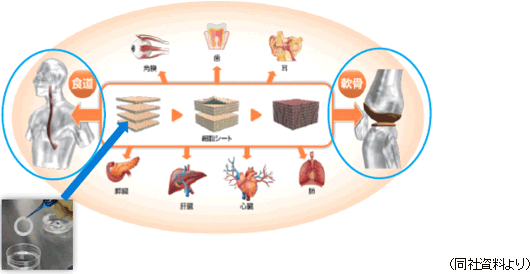 再生医療支援事業
温度応答性細胞培養器材等の開発・製造・販売、及び再生医療に関わる総合的なサポートサービスを提供する再生医療受託サービスを手掛けている。
再生医療支援事業
温度応答性細胞培養器材等の開発・製造・販売、及び再生医療に関わる総合的なサポートサービスを提供する再生医療受託サービスを手掛けている。
 再生医療受託サービスでは、細胞シート製品の製法開発・受託製造、施設管理・申請支援、細胞培養技術者教育等のサービスを提供している。
細胞シート製品の製法開発・受託製造
製薬会社・研究機関からの委託を受けて、主に細胞シートの受託開発・製造を行う。日本再生医療学会認定の臨床培養士が所属しており、培養の経験豊富なスタッフによる高品質な細胞シートを用いた再生医療等製品の製法開発・製造を特定細胞加工物の製造許可を受けた細胞培養加工施設で行う。
尚、細胞シート再生医療事業で研究開発を進めている軟骨再生シートは東海大学が申請していた先進医療が2019年1月に承認され、それを踏まえて治験の準備が進められている。この先進医療に使用される細胞シートは同社が東海大学からの委託を受けて細胞培養センターで培養(受託加工)する事が決まっている。
施設管理・申請支援
「再生医療等の安全性の確保等に関する法律」では、構造設備や細胞加工の運用が規定され、細胞培養加工施設毎に厚生労働大臣に届出・許可申請を行う必要がある。同社は、特定細胞加工物の製造の届出や申請資料の作成、運営に必要な文書作成等の支援を行う。また、治験届等の申請で必要となる当局相談に対する相談資料の作成、申請資料の作成等、必要な行政手続きも支援する。
細胞培養技術者教育
細胞シートの培養や剥離手順等、これまで細胞シートに触れた経験がない培養技術者等に対する教育を実施する。
細胞培養センター
延床面積約763 ㎡で、自動モニタリングシステムによって、清浄度、室圧、温湿度、機器(培養器や保冷庫等)が自動管理され、監視カメラシステムも完備。また、羽田空港まで車で約20分と至近で空輸にも対応しやすい。2017年3月には「再生医療等の安全性の確保等に関する法律第35 条第1項の規定に基づく「特定細胞加工物製造許可」(許認可権者:厚生労働省)を取得しており、特定細胞加工物の受託製造も可能。
再生医療受託サービスでは、細胞シート製品の製法開発・受託製造、施設管理・申請支援、細胞培養技術者教育等のサービスを提供している。
細胞シート製品の製法開発・受託製造
製薬会社・研究機関からの委託を受けて、主に細胞シートの受託開発・製造を行う。日本再生医療学会認定の臨床培養士が所属しており、培養の経験豊富なスタッフによる高品質な細胞シートを用いた再生医療等製品の製法開発・製造を特定細胞加工物の製造許可を受けた細胞培養加工施設で行う。
尚、細胞シート再生医療事業で研究開発を進めている軟骨再生シートは東海大学が申請していた先進医療が2019年1月に承認され、それを踏まえて治験の準備が進められている。この先進医療に使用される細胞シートは同社が東海大学からの委託を受けて細胞培養センターで培養(受託加工)する事が決まっている。
施設管理・申請支援
「再生医療等の安全性の確保等に関する法律」では、構造設備や細胞加工の運用が規定され、細胞培養加工施設毎に厚生労働大臣に届出・許可申請を行う必要がある。同社は、特定細胞加工物の製造の届出や申請資料の作成、運営に必要な文書作成等の支援を行う。また、治験届等の申請で必要となる当局相談に対する相談資料の作成、申請資料の作成等、必要な行政手続きも支援する。
細胞培養技術者教育
細胞シートの培養や剥離手順等、これまで細胞シートに触れた経験がない培養技術者等に対する教育を実施する。
細胞培養センター
延床面積約763 ㎡で、自動モニタリングシステムによって、清浄度、室圧、温湿度、機器(培養器や保冷庫等)が自動管理され、監視カメラシステムも完備。また、羽田空港まで車で約20分と至近で空輸にも対応しやすい。2017年3月には「再生医療等の安全性の確保等に関する法律第35 条第1項の規定に基づく「特定細胞加工物製造許可」(許認可権者:厚生労働省)を取得しており、特定細胞加工物の受託製造も可能。

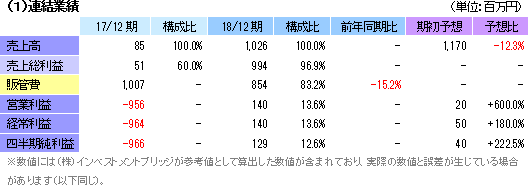 会計方針の変更
従来、再生医療研究開発に係る補助金を営業外収益の「補助金収入」に含めていたが、費用負担の実態を明確にし、損益区分をより適正に表す事を目的に、18/12期より販管費の「研究開発費」から控除する方法に変更した。18/12期との比較を可能にするため、17/12期の販管費及び営業損失を遡及した。
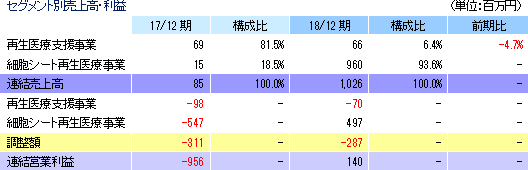
売上高10億26百万円(前期は85百万円)、営業利益1億40百万円(同 営業損失9億56百万円)
売上面では、再生医療支援事業の売上は前期と同水準の66百万円にとどまったが、細胞シート再生医療事業において台湾での独占的事業提携契約に基づく売上9億60百万円を計上した。利益面では、売上総利益が大幅に増加する中、研究開発費が前期の5億64百万円から4億32百万円に、その他の販管費が4億43百万円から4億21百万円に、それぞれ減少し、結果として大幅な増益となった。期初予想に対しては、新たな事業提携・ライセンシングの契約がなかったため売上が未達となったものの、開発業務委託費用や細胞培養施設の維持の支出が下回った事等で、各利益が期初予想を大幅に上回った。
会計方針の変更
従来、再生医療研究開発に係る補助金を営業外収益の「補助金収入」に含めていたが、費用負担の実態を明確にし、損益区分をより適正に表す事を目的に、18/12期より販管費の「研究開発費」から控除する方法に変更した。18/12期との比較を可能にするため、17/12期の販管費及び営業損失を遡及した。
売上高10億26百万円(前期は85百万円)、営業利益1億40百万円(同 営業損失9億56百万円)
売上面では、再生医療支援事業の売上は前期と同水準の66百万円にとどまったが、細胞シート再生医療事業において台湾での独占的事業提携契約に基づく売上9億60百万円を計上した。利益面では、売上総利益が大幅に増加する中、研究開発費が前期の5億64百万円から4億32百万円に、その他の販管費が4億43百万円から4億21百万円に、それぞれ減少し、結果として大幅な増益となった。期初予想に対しては、新たな事業提携・ライセンシングの契約がなかったため売上が未達となったものの、開発業務委託費用や細胞培養施設の維持の支出が下回った事等で、各利益が期初予想を大幅に上回った。


 「食道再生上皮シート」による治療は、食道がん再生治療法(食道創傷治癒・狭窄予防)として東京女子医大先端研が開発した治療法である。患者の口腔粘膜から採取した細胞を温度応答性培養器材で約2週間かけて培養し、細胞シートを作成する。細胞シートの培養に合わせて、食道がん切除内視鏡手術を行い、食道潰瘍面に移植する。
2008年から2014年にかけて大学で臨床研究が行われ、東京女子医科大学10症例、東京女子医科大学・長崎大10症例(長距離輸送検証:長崎大で採取した細胞を東京女子医大で培養し、長崎大で移植手術)、カロリンスカ大学病院(スウェーデン)10症例、の計30症例が既にあり、同社は、東京女子医科大学と開発基本合意契約を締結して同大学の研究成果を実業化に向けて引き継いだ。
国内では、16/12期第2四半期(4月)の治験届を経て、同第3四半期(8月)に国立がん研究センター(中央病院、東病院の2施設)及び東京女子医大において治験を開始した。18/12期第2四半期に症例登録を終了し、19/12期第1四半期に治験を終了した。
海外では、子会社CellSeed Sweden AB(スウェーデン)を15/12期第2四半期(5月)に設立し、同第4四半期(11月)にはスウェーデン医薬品庁(MPA)に事前相談を行った。また、17/12期第1四半期(4月)に台湾のMetaTech社と事業提携契約を締結し、同社が2018年12月末に治験届を提出した。
治験結果の概要 有効性についての十分なデータが得られず追加の治験実施へ
治験において、副作用の発生はなく、安全性についての問題は認められなかった。ただ、その一方で、主要評価項目である「ESD(内視鏡的粘膜切除術)後8週目の狭窄予防効果」の有効率(非狭窄率)が12.5%にとどまり、閾値奏効率(ESD後の無処置患者に対する非狭窄率)に対して統計的な優位性が証明されなかった。
同社は、上記治験結果について、データ確定作業と並行して承認機関である独立行政法人医薬品医療機器総合機構(PMDA)との先駆け定期面談の中で協議を進めてきたが、2019年2月にPMDAより、「安全性は確認できたものの、有効性については十分なデータであるとは言い切れず、製造販売承認申請については追加の臨床試験を実施し、有効性を確認するデータの提出が必要である」との回答を受けた。これを受けて同社は追加臨床試験を実施すべく、PMDAと協議を続けていく考え。19/12期中に追加治験の治験届を提出し、21/12期の追加治験終了、22/12期の製造販売承認申請を目指している。
「食道再生上皮シート」による治療は、食道がん再生治療法(食道創傷治癒・狭窄予防)として東京女子医大先端研が開発した治療法である。患者の口腔粘膜から採取した細胞を温度応答性培養器材で約2週間かけて培養し、細胞シートを作成する。細胞シートの培養に合わせて、食道がん切除内視鏡手術を行い、食道潰瘍面に移植する。
2008年から2014年にかけて大学で臨床研究が行われ、東京女子医科大学10症例、東京女子医科大学・長崎大10症例(長距離輸送検証:長崎大で採取した細胞を東京女子医大で培養し、長崎大で移植手術)、カロリンスカ大学病院(スウェーデン)10症例、の計30症例が既にあり、同社は、東京女子医科大学と開発基本合意契約を締結して同大学の研究成果を実業化に向けて引き継いだ。
国内では、16/12期第2四半期(4月)の治験届を経て、同第3四半期(8月)に国立がん研究センター(中央病院、東病院の2施設)及び東京女子医大において治験を開始した。18/12期第2四半期に症例登録を終了し、19/12期第1四半期に治験を終了した。
海外では、子会社CellSeed Sweden AB(スウェーデン)を15/12期第2四半期(5月)に設立し、同第4四半期(11月)にはスウェーデン医薬品庁(MPA)に事前相談を行った。また、17/12期第1四半期(4月)に台湾のMetaTech社と事業提携契約を締結し、同社が2018年12月末に治験届を提出した。
治験結果の概要 有効性についての十分なデータが得られず追加の治験実施へ
治験において、副作用の発生はなく、安全性についての問題は認められなかった。ただ、その一方で、主要評価項目である「ESD(内視鏡的粘膜切除術)後8週目の狭窄予防効果」の有効率(非狭窄率)が12.5%にとどまり、閾値奏効率(ESD後の無処置患者に対する非狭窄率)に対して統計的な優位性が証明されなかった。
同社は、上記治験結果について、データ確定作業と並行して承認機関である独立行政法人医薬品医療機器総合機構(PMDA)との先駆け定期面談の中で協議を進めてきたが、2019年2月にPMDAより、「安全性は確認できたものの、有効性については十分なデータであるとは言い切れず、製造販売承認申請については追加の臨床試験を実施し、有効性を確認するデータの提出が必要である」との回答を受けた。これを受けて同社は追加臨床試験を実施すべく、PMDAと協議を続けていく考え。19/12期中に追加治験の治験届を提出し、21/12期の追加治験終了、22/12期の製造販売承認申請を目指している。
 10症例登録し、うち2症例がドロップしたため、最終的に8症例となったが、有効性を確認できたのは1症例にとどまった。治験の選択基準、言い換えると、切除する範囲の基準を、切除周在率75%以上、切除長軸径80mm未満、として治験を実施したが、8症例のうち、この範囲に収まったのは2症例にとどまり、6症例の長軸径が80mm以上と当初設定した選択基準値を実際の手術の際には超える大きさとなった。この辺りが再生医療製品の治験の難しさであると言う。切除範囲が大きくなると、狭窄の発生確率が高くなる。ちなみに、臨床研究と治験合計の選択基準内の有効率は57.1%(14症例中8症例で有効性が確認できた)。
治験開始に向け、軟骨再生シートの開発を加速
東海大学との共同研究
同社は2004年に温度応答性細胞培養皿の提供を開始し、2006年に共同研究を開始した。2010年以降は、同大学で始まった臨床研究を支援し、2014年には同社から研究員を派遣し、共同研究体制を強化した。自己細胞シート移植の臨床研究が2011年8月に第65回厚生科学審議会科学技術部会で承認され、同年10月に厚生労働大臣の意見書(厚生労働省発医政1003第3号)が発出された。同年11月に第1例目臨床研究が始まり、2015年11月に8例の2年後評価が終了した。また、2019年1月には厚生労働省「第71回先進医療会議」において、東海大学医学部付属病院が申請していた「自己細胞シートによる軟骨再生治療が」が先進医療として承認された。同社は軟骨再生シートを受託製造する。
尚、同社と東海大学は、国立研究開発法人日本医療研究開発機構(AMED)が公募した補助事業である平成30年度「再生医療の産業化に向けた評価基盤技術開発事業(再生医療シーズ開発加速支援)を通じて変形性膝関節症治療のための軟骨細胞シートの有効性因子の探索や同種軟骨再生シートの治療に向けた研究開発を共同で進めている他、AMEDの「自己軟骨細胞シートのための統合的評価手法」プロジェクトにも(株)DNAチップ研究所と共に参画している。
10症例登録し、うち2症例がドロップしたため、最終的に8症例となったが、有効性を確認できたのは1症例にとどまった。治験の選択基準、言い換えると、切除する範囲の基準を、切除周在率75%以上、切除長軸径80mm未満、として治験を実施したが、8症例のうち、この範囲に収まったのは2症例にとどまり、6症例の長軸径が80mm以上と当初設定した選択基準値を実際の手術の際には超える大きさとなった。この辺りが再生医療製品の治験の難しさであると言う。切除範囲が大きくなると、狭窄の発生確率が高くなる。ちなみに、臨床研究と治験合計の選択基準内の有効率は57.1%(14症例中8症例で有効性が確認できた)。
治験開始に向け、軟骨再生シートの開発を加速
東海大学との共同研究
同社は2004年に温度応答性細胞培養皿の提供を開始し、2006年に共同研究を開始した。2010年以降は、同大学で始まった臨床研究を支援し、2014年には同社から研究員を派遣し、共同研究体制を強化した。自己細胞シート移植の臨床研究が2011年8月に第65回厚生科学審議会科学技術部会で承認され、同年10月に厚生労働大臣の意見書(厚生労働省発医政1003第3号)が発出された。同年11月に第1例目臨床研究が始まり、2015年11月に8例の2年後評価が終了した。また、2019年1月には厚生労働省「第71回先進医療会議」において、東海大学医学部付属病院が申請していた「自己細胞シートによる軟骨再生治療が」が先進医療として承認された。同社は軟骨再生シートを受託製造する。
尚、同社と東海大学は、国立研究開発法人日本医療研究開発機構(AMED)が公募した補助事業である平成30年度「再生医療の産業化に向けた評価基盤技術開発事業(再生医療シーズ開発加速支援)を通じて変形性膝関節症治療のための軟骨細胞シートの有効性因子の探索や同種軟骨再生シートの治療に向けた研究開発を共同で進めている他、AMEDの「自己軟骨細胞シートのための統合的評価手法」プロジェクトにも(株)DNAチップ研究所と共に参画している。
 同種細胞シート移植の開発
同種細胞シート移植についても、2017年2月15日に世界初となる第1例目の臨床研究が行われた(移植手術を実施)。この臨床研究は、多指症患者から軟骨組織を採取し、2~3週間かけて培養した細胞シートを移植するもので(先天的に手の指が6本ある乳児から切除された指の軟骨細胞を同意を得て利用)、今後3年間で10名の患者への移植を計画しており、2020年3月までに移植を終了する予定。並行してセルバンクの構築と細胞シート製造の自動化にも着手した。2021年に企業治験を開始する予定でAMEDから支援を受けている。
再生医療受託サービス
再生医療受託サービスでは、細胞シート製品の製法開発・受託製造、施設管理・申請支援、細胞培養技術者教育等のサービスを提供している。
細胞シート製品の製法開発・受託製造では、細胞シート製品の製造受託や品質試験等を手掛けている。特徴は、日本再生医療学会認定の臨床培養士等、培養の知識・経験豊富なスタッフが多数所属し、特定細胞加工物製造の許可を受けた施設(施設番号:FA3160008)において、同社製品であるUpCellRを用いて細胞シートを作製する事である。AMEDに採択された東京女子医科大学先端生命医学研究所(研究開発担当者 岩田隆紀氏)の再生医療実用化研究事業「同種歯根膜由来間葉系幹細胞シートによる歯周組織の再建」における同種歯根膜由来間葉系幹細胞シートの製造関連業務を2018年11月に受注した。
施設管理・申請支援では、特定細胞加工物の製造の申請資料の作成や申請・届出や文書作成コンサルティング、施設設備・管理体制の維持、管理支援等のサービスを提供しており、細胞培養技術者教育では、細胞シート培養トレーニングや細胞シート剥離トレーニング等のサービスを提供している。
次期開発品目の検討
2020年末までに、食道再生上皮シート(日本)、軟骨再生シート(日本)に次ぐ第3品目目の開発案件を選定して事業化を開始する。具体的な開発品目・地域については研究実施機関との契約等、準備が整い次第着手する。
世界展開に向けた事業提携推進
既存契約先の台湾のMetaTech社の支援を推進する。同社、MetaTech社、と共同で台湾政府の下で、新規研究開発拠点の設立に向けた活動を予定している。また、新規契約の獲得にも取り組む。具体的には、事業提携・ライセンシングに向け、アジア諸国・欧米を中心に活動を継続する(MetaTech社の様に開発中案件に関心を示す交渉先企業はあるものの、18/12期の契約締結はなかった)。開発中パイプラインの開発推進による事業価値向上と並行して、アジア諸国・欧米をターゲットに問う中期経営計画期間中に新規事業提携先の獲得を目指す。
尚、MetaTech社とは2017年4月に事業提携契約を締結し、細胞シート再生医療事業(食道再生上皮シート及び軟骨再生シート)の台湾での独占的な開発・製造・販売権を付与した。(株)セルシードの支援の下で、MetaTech社が台湾での開発・事業化を推進する。
18/12期に開発進捗に応じた技術移転料等9億60百万円を受領した。
同種細胞シート移植の開発
同種細胞シート移植についても、2017年2月15日に世界初となる第1例目の臨床研究が行われた(移植手術を実施)。この臨床研究は、多指症患者から軟骨組織を採取し、2~3週間かけて培養した細胞シートを移植するもので(先天的に手の指が6本ある乳児から切除された指の軟骨細胞を同意を得て利用)、今後3年間で10名の患者への移植を計画しており、2020年3月までに移植を終了する予定。並行してセルバンクの構築と細胞シート製造の自動化にも着手した。2021年に企業治験を開始する予定でAMEDから支援を受けている。
再生医療受託サービス
再生医療受託サービスでは、細胞シート製品の製法開発・受託製造、施設管理・申請支援、細胞培養技術者教育等のサービスを提供している。
細胞シート製品の製法開発・受託製造では、細胞シート製品の製造受託や品質試験等を手掛けている。特徴は、日本再生医療学会認定の臨床培養士等、培養の知識・経験豊富なスタッフが多数所属し、特定細胞加工物製造の許可を受けた施設(施設番号:FA3160008)において、同社製品であるUpCellRを用いて細胞シートを作製する事である。AMEDに採択された東京女子医科大学先端生命医学研究所(研究開発担当者 岩田隆紀氏)の再生医療実用化研究事業「同種歯根膜由来間葉系幹細胞シートによる歯周組織の再建」における同種歯根膜由来間葉系幹細胞シートの製造関連業務を2018年11月に受注した。
施設管理・申請支援では、特定細胞加工物の製造の申請資料の作成や申請・届出や文書作成コンサルティング、施設設備・管理体制の維持、管理支援等のサービスを提供しており、細胞培養技術者教育では、細胞シート培養トレーニングや細胞シート剥離トレーニング等のサービスを提供している。
次期開発品目の検討
2020年末までに、食道再生上皮シート(日本)、軟骨再生シート(日本)に次ぐ第3品目目の開発案件を選定して事業化を開始する。具体的な開発品目・地域については研究実施機関との契約等、準備が整い次第着手する。
世界展開に向けた事業提携推進
既存契約先の台湾のMetaTech社の支援を推進する。同社、MetaTech社、と共同で台湾政府の下で、新規研究開発拠点の設立に向けた活動を予定している。また、新規契約の獲得にも取り組む。具体的には、事業提携・ライセンシングに向け、アジア諸国・欧米を中心に活動を継続する(MetaTech社の様に開発中案件に関心を示す交渉先企業はあるものの、18/12期の契約締結はなかった)。開発中パイプラインの開発推進による事業価値向上と並行して、アジア諸国・欧米をターゲットに問う中期経営計画期間中に新規事業提携先の獲得を目指す。
尚、MetaTech社とは2017年4月に事業提携契約を締結し、細胞シート再生医療事業(食道再生上皮シート及び軟骨再生シート)の台湾での独占的な開発・製造・販売権を付与した。(株)セルシードの支援の下で、MetaTech社が台湾での開発・事業化を推進する。
18/12期に開発進捗に応じた技術移転料等9億60百万円を受領した。
 再生医療支援事業において、2018年11月に第1号案件を受注した再生医療受託サービスの堅調な推移が見込まれるものの、全社ベースでは、19/12期、20/12期と先行投資が続く見込み。21/12期は、細胞シート再生医療事業において、新たな提携による収益を見込でいる。
(株)セルシード主催イベントフォーラムの開催
第1回細胞シート工学イノベーションフォーラムを2019年7月19日(13:30~18:00)に開催する。会場は東京都立産業技術研究センター、定員150名(事前登録制、先着順、研究者対象)。
講演予定者は、岡野光夫 東京女子医大名誉教授、清水達也東京女子医大先端生命医科学研究所 所長、佐藤正人 東海大学医学部外科学系整形外科学 教授、岩田隆紀 東京医科歯科大学 大学院歯学総合研究科 歯周病学分野 主任教授。
尚、「細胞シート」又は「温度応答性細胞培養器材」を用いた研究のポスター演題を募集している。
再生医療支援事業において、2018年11月に第1号案件を受注した再生医療受託サービスの堅調な推移が見込まれるものの、全社ベースでは、19/12期、20/12期と先行投資が続く見込み。21/12期は、細胞シート再生医療事業において、新たな提携による収益を見込でいる。
(株)セルシード主催イベントフォーラムの開催
第1回細胞シート工学イノベーションフォーラムを2019年7月19日(13:30~18:00)に開催する。会場は東京都立産業技術研究センター、定員150名(事前登録制、先着順、研究者対象)。
講演予定者は、岡野光夫 東京女子医大名誉教授、清水達也東京女子医大先端生命医科学研究所 所長、佐藤正人 東海大学医学部外科学系整形外科学 教授、岩田隆紀 東京医科歯科大学 大学院歯学総合研究科 歯周病学分野 主任教授。
尚、「細胞シート」又は「温度応答性細胞培養器材」を用いた研究のポスター演題を募集している。
 基本的な考え方
当社は、技術革新と創造性を発揮し、質の高い優れた製品とサービスの提供を通じ人々の健康と福祉に貢献していくことを使命とし、全ての企業活動において品質を高めるべく企業統治の整備を進めています。
今後につきましては、ディスクロージャーの透明性を高めるため一層説明責任を充実するとともに、さらなる経営のチェック機能強化を図ってまいります。
<実施しない主な原則とその理由>
当社は、JASDAQ上場企業としてコーポレートガバナンス・コードの基本原則をすべて実施しております。
基本的な考え方
当社は、技術革新と創造性を発揮し、質の高い優れた製品とサービスの提供を通じ人々の健康と福祉に貢献していくことを使命とし、全ての企業活動において品質を高めるべく企業統治の整備を進めています。
今後につきましては、ディスクロージャーの透明性を高めるため一層説明責任を充実するとともに、さらなる経営のチェック機能強化を図ってまいります。
<実施しない主な原則とその理由>
当社は、JASDAQ上場企業としてコーポレートガバナンス・コードの基本原則をすべて実施しております。




