ブリッジレポート:(4592) サンバイオ 2020年1月期第2四半期決算
 森 敬太 社長 | サンバイオ株式会社(4592) |
 |
企業情報
市場 | 東証マザーズ |
業種 | 医薬品 |
代表取締役社長 | 森 敬太 |
所在地 | 東京都中央区明石町8-1 聖路加タワー28F |
決算月 | 1月末日 |
HP |
株式情報
株価 | 発行済株式数 | 時価総額 | ROE(実) | 売買単位 | |
3,895円 | 51,734,223株 | 201,504百万円 | -60.2% | 100株 | |
DPS(予) | 配当利回り(予) | EPS(予) | PER(予) | BPS(実) | PBR(実) |
0.00円 | - | -108.48円 | - | 267.00円 | 14.6倍 |
*株価は10/17終値。発行済株式数、DPS、EPS、BPSは20年1月期第2四半期決算短信より。ROEは前期実績。
業績推移
決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 | EPS | DPS |
2016年1月(実) | 1,174 | -1,125 | -1,172 | -988 | -22.67 | 0.00 |
2017年1月(実) | 949 | -1,932 | -2,166 | -1,835 | -40.88 | 0.00 |
2018年1月(実) | 490 | -4,378 | -3,947 | -3,940 | -86.85 | 0.00 |
2019年1月(実) | 741 | -3,733 | -2,919 | -2,920 | -60.17 | 0.00 |
2020年1月(予) | 713 | -5,887 | -5,390 | -5,395 | -108.48 | 0.00 |
*単位:百万円、円。予想は会社側予想。当期純利益は親会社株主に帰属する当期純利益。(以下、同様)
サンバイオグループ(サンバイオ株式会社及びその米国子会社であるSanBio Inc.)の業績動向、今後の事業戦略等をお伝えします。
目次
今回のポイント
1.会社概要
2.再生細胞薬事業化の進捗
3.今後の事業目標と目指す姿
4.業績動向
5.森社長に聞く
6.今後の注目点
<参考:コーポレートガバナンスについて>
今回のポイント
- 20年1月期通期業績予想に変更はない。研究開発費は前期比14億83百万円増加の51億95百万円。製造および国内自販体制などSB623の安定供給に向けた基盤整備のための投資が中心。「2020年 製薬企業への脱皮」を目指し、国内での慢性期外傷性脳損傷適応での承認申請を行うほか、国内自販体制の構築、安定供給体制の基盤整備を進める。また、「2025年 グローバルリーダーへの成長」のために、慢性期外傷性脳損傷適応でのグローバル試験開始、慢性期脳梗塞および慢性期脳出血適応での開発進行、グローバル展開のための適応拡大も含めたパイプライン強化に取り組んでいく。
- 森社長にRMAT指定の意味するところ、再生医療プラットフォーム構想、今後注目すべきポイントなどを伺った。RMAT指定については、「SB623は優先的な審査実施に値するという高い評価を頂いた。事業化に向けて大きな一歩を進めることができたという点を是非投資家の皆さんにご理解いただきたい。」とのこと。また投資家には「来年2020年に製薬企業へ脱皮した後、2025年にはグローバルリーダーへと成長することを目標とする当社をこれからも応援していただきたい。」とのメッセージを送っている。
- 慢性期外傷性脳損傷プログラムの開発に関し、日本における「先駆け審査指定制度」の対象品目の指定、米国脳神経外科学会における日米グローバルのフェーズ2臨床試験についての学会発表、欧州医薬品庁による「SB623」の先端医療医薬品指定に加え、米国FDAによる「SB623」のRMAT指定と、大きなトピックスが相次いでいる。2020年1月期中の再生医療等製品としての製造販売の承認申請、2021年1月期中の慢性期外傷性脳損傷プログラムのグローバルフェーズ3臨床試験開始がまた一段と実現に近づいているようだ。また開発だけでなく、製品化後の量産・流通体制構築も着実に進んでいる。
- 一方で適応疾患拡大のための開発投資も今後は増加していくと思われ、そうした中でPLおよびCFがグローバルリーダーへの成長を目指す2025年あたりに向けどのような状況に向かうと会社側が想定しているのかも注目したい。
1.会社概要
未だ有効な治療法のない慢性期脳梗塞など中枢神経系疾患等を治療する再生細胞薬を開発するバイオベンチャー。世界の再生医療の中心地である日本とアメリカに拠点を構え世界的な事業展開を図る。確立された量産化技術、競争優位性を高める特許戦略なども大きな強み。適応疾患と地域の拡大という掛け算による成長を目指す。
【1-1 上場までの沿革】
麒麟麦酒株式会社(現 キリンホールディングス)で研究開発を行っていた森 敬太氏(サンバイオ株式会社 代表取締役社長)は、自ら新しい事業に挑戦したいと考えていたところ、旧知の友人で、大手コンサルティング会社ボストンコンサルティング・グループのコンサルタントを経て、製薬企業向け営業支援を行う(株)ケアネット(2150、東証マザーズ)の創業に携り同社副社長であった川西 徹氏(サンバイオ株式会社 代表取締役会長)と、起業に関して意気投合した。
将来の方向性など様々な議論を行うなか、2人とも大学時代に農学部でバイオテクノロジーを専攻していたこともあり、「バイオの世界で、新しい分野、新しい市場を創り出す」ことに目標を定めた。具体的な分野として将来性の大きい「再生細胞薬」に注目し、その製品化・事業化を目指して、2001年2月、SanBio, Inc.を米国カリフォルニア州に設立した。
創業にあたり、慶應義塾大学 岡野栄之(ひでゆき)教授(脳神経領域の再生医療、iPS研究で世界の第一人者。現在、慶應義塾大学大学院医学研究科委員長、日本再生医療学会理事ほか)の研究分野に着目し、協力を願い出たところ快諾を得て、同氏の紹介もあり、2002年12月、神奈川県内の国公私立大学の研究成果を企業に橋渡しする技術移転機関「よこはまティーエルオー株式会社」から、現在の開発品の基本技術となっている基本シーズに係る知的財産の譲渡を受けた。岡野氏は創業科学者としてサンバイオの創業以来、科学的な見地からのアドバイスを提供している。一方、米国では、再生医療分野での強力なネットワークを通じて、各分野の有力なアドバイザーや、優秀な研究員を獲得し、再生細胞薬の開発、製造及び大量生産技術の確立を進めてきた。
サンバイオは、同社の開発する再生細胞薬の開発・販売について、大手製薬会社との提携を模索していたが、2009年12月に再生細胞薬「SB623」の日本における脳梗塞用途の開発専用実施権許諾契約を帝人株式会社と締結。翌2010年5月には脳梗塞について、米国食品医薬品局(Food and Drug Administration以下、FDA)から臨床試験開始の承認を取得した。一方、2010年9月には大日本住友製薬株式会社と米国及びカナダにおける脳梗塞用途のオプション契約を締結。
2011年1月には米国において「SB623」の慢性期の脳梗塞を対象とした臨床試験(フェーズ1/2a)を開始し、2013年8月には被験者18名に「SB623」の投与を完了し、SB623の安全性と統計学的に有意な有効性データが確認された。
2012年12月に京都大学の山中伸弥教授がiPS細胞の開発でノーベル賞を受賞したことに加え、2014年11月に改正薬事法及び再生医療新法が施行され、再生医療等製品について早期承認制度がスタートしたのを契機に、再生医療分野での日本の存在価値が世界的に急速にクローズアップされるなか、これを絶好の機会と捉え、日本を経営の中心に米国を研究開発の拠点に世界的な事業展開を図るべく、2013年2月、日本にサンバイオ株式会社を設立。2014年1月には、サンバイオ㈱を親会社、米国のSanBio, Inc.を完全子会社とする企業再編を行い、2015年4月東証マザーズ市場に上場を果たし、日本におけるバイオベンチャーIPOとしては最大規模の73億円を調達した。
【1-2 サンバイオグループと開発体制】
沿革で触れたように、同社グループは、サンバイオ株式会社とその連結子会社SanBio. Inc.(米国カリフォルニア州)の2社から構成されている。
再生細胞薬の研究開発については、2001年の創業以来一貫して、米国SanBio, Inc.の世界最高の開発・製造チームが中心になって手掛けているが、世界を見据えた事業展開を視野に、現在日本においても開発体制の拡充を進めている。
創業科学者の岡野栄之氏は脳神経領域の再生医療及びiPS細胞研究における世界の第一人者で、従来の「脳は再生しない」という常識を覆した。同社に対しては、創業時から科学的見地からのアドバイスを提供している。
米国においては、FDA元長官、スタンフォード大学元学長、米国国立衛生研究所(NIH)老化研究所元所長らをアドバイザーに迎え、開発に必要なアドバイスを受けている。
また、スタンフォード大学、ピッツバーグ大学、ニューヨーク大学、カリフォルニア大学ロサンゼルス校(UCLA)、ノースウェスタン大学などの先端医療を進める研究機関とも連携し、再生医療という先端分野に必要な強力なネットワークを構築している。
シニア・アドバイザーのダミアン・ベイツ医師は、世界で初めて「他家」細胞医薬品のFDA承認取得を成功させた人物。再生医療の「自家」移植については承認が下りているものが複数例あるものの、「他家」については、同氏の実績がいまだ唯一のFDA承認となっている。(「他家」「自家」については、【事業内容とビジネスモデル】にて後述)
2019年5月にダミアン・ベイツ医師の後を継いでチーフ・メディカル・オフィサーに就任したジャン・ネジャドニク医師は腫瘍性治療薬において複数製品の生物製剤承認申請を行い、アメリカ食品医薬品局及び欧州医薬品庁より医薬品の承認を取得するなど、生物製剤や遺伝子組み換え製剤の開発に豊富な経験を有しており、同社グループの開発体制は更に強化された。
【1-3 企業理念】
慢性期(※1)脳梗塞、外傷性脳損傷、脳出血、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等のアンメットメディカルニーズ(※2)の高い疾患を対象に再生細胞薬による治療法を確立することで、世界中のこれら疾患を抱えた患者の治療・身体機能の改善に寄与することをグループのミッションとしている。
※1慢性期:同社では、発症もしくは受傷後6か月あるいは6か月以上が経過したものを慢性期と定義している。
※2アンメットメディカルニーズ:未だ有効な治療法がない治療ニーズ。

【1-4 同社を理解する上でのポイント】
同社の事業内容を理解するには、細胞、脳の再生、再生医療など知っておくべきポイントがいくつかある。
<細胞>
ヒトの体は37兆個以上、200種類以上の細胞で構成されていると言われている。
ヒトは、もともとは1つの受精卵から始まり、分裂、増殖を繰り返しながら、神経細胞、心筋細胞、肝細胞など、成体を構成する様々な細胞に分化(変化)していく。
ヒトの体の中には、このように最終的に分化した細胞と分化途上の細胞が存在しており、前者を体細胞、後者を体性幹細胞と言う。
体性幹細胞としては、造血幹細胞、神経幹細胞、間葉系幹細胞などがあり、これらは、限定された範囲内で各種の細胞に分化する。例えば、造血幹細胞は、骨髄に多く存在することが知られており、白血球や血小板など全ての血液系細胞を作り出しているが、通常、他の異なる細胞種には分化しない。
<脳の再生>
胎生期(受精から約9か月)においては、ヒトの脳には神経細胞の元となる神経幹細胞が存在し、それが活発に分裂・分化することで、新たな神経細胞が活発に生み出されている。しかし、この分裂能力は成体(成人の体)では消失し、大人の脳では新たな神経細胞は生み出されないと考えられてきた。
しかし、近年の研究で、成体の脳にも神経幹細胞は存在し、新たに神経細胞やその他の細胞を作る能力があることがわかってきた。
これを発見し脳神経細胞を再生させることに成功したのが同社創業科学者の岡野栄之氏である。
<ES細胞・iPS細胞 対 間葉系幹細胞(MSC)>
ES細胞(胚性幹細胞:Embryonic stem cell)は、幹細胞に比べると、より多くの種類の細胞に分化する能力があり、理論上は、心筋、神経、肝臓、血液など体内の全ての種類の細胞に分化することが可能。
体性幹細胞は限られた範囲内でしか分化できないのに対し、ES細胞では分化できる範囲が格段に広いのが大きな特徴である。
ES細胞は、不妊治療の過程で不要になった余剰胚から作製するケースが多いようだが、受精卵を使用することに関して各国で様々な倫理的議論がなされている。中絶胎児由来の細胞を使用する場合、倫理面で問題視する声も少なくない。
2007年に、京都大学の山中伸弥教授が発明した受精卵を使用しない新たな万能細胞が、「iPS細胞(人工多能性幹細胞、induced pluripotent stem cell)」である。ヒトの皮膚細胞からiPS細胞を作製することに成功している。
iPS細胞は心筋、神経、肝臓、血液など様々な細胞に分化するという点でES細胞とほぼ同等の性質を持っているが、ES細胞のような倫理上の問題は無い反面、無制限に増殖するためがん化リスクが指摘されている。
一方、健常人の骨髄液から採取される間葉系幹細胞(MSC)は、古くから骨髄移植に使用されており、倫理面での問題はなく、ガン化の報告もない。他の細胞に分化する能力を持つ一方、体内に移植されると1か月以内に消失する。(サンバイオの例では)非臨床試験で成長因子を出す等して、神経細胞の回復を促す。
(細胞の種類と特長)
細胞の種類 | 分化能 | 増殖性 | 再生医療におけるリスク・課題 |
体細胞 | 分化しない | 増殖は限定的 | 無し |
体性幹細胞 (造血幹細胞、神経幹細胞、間葉系幹細胞など) | 限定的な細胞種に分化可能 | 増殖は限定的 | 無し |
ES細胞 (胚性幹細胞) | あらゆる細胞に分化可能 (多分化能) | 高い増殖能 | 倫理上の課題(不妊治療の過程で不要になった余剰胚から作製。中絶を伴う胎児由来細胞の使用)、ガン化 |
iPS細胞 (人工多能性幹細胞) | あらゆる細胞に分化可能 (多分化能) | 高い増殖能 | ガン化 |
<再生医療>
①再生医療とは
再生医療とは、損傷を受けた生体の機能を、細胞や、細胞外マトリクスや成長因子などを用いて復元または活性化させる医療。具体的には、患者に患者本人若しくはドナーの幹細胞を移植し、目的の細胞に分化したり、既存の細胞に作用したりすることで疾患を治療するもので、従来はなし得なかった根本的な治療を可能にすると言われている。
②世界が注目する日本の事業環境
経済産業省の資料によると、2012年に国内90億円、海外1,000億円だったと推計される再生医療市場は、2050年にそれぞれ2.5兆円、38兆円規模に拡大する見込み。
2006年、2007年に山中教授がiPS細胞に関する画期的な成果を上げる一方で、米国では2009年3月にオバマ大統領が、ブッシュ政権が禁じていたES細胞への連邦政府助成を解禁する法案に署名するなど再生医療における研究競争が激化する中、日本では「激化する研究競争を勝ち抜き、患者のための臨床技術とするためには、産学官が一体となった強力な体制が必要不可欠」(「再生・細胞医療の現状及び課題 2012年9月26日 厚生労働省 医政局研究開発振興課」より)との認識が強まり、「再生医療」は日本再興戦略の重要テーマの一つとして掲げられることとなった。
そうした動きに応じて、2014年11月25日には医薬品医療機器等法(薬事法が改正・名称変更された。以下、改正薬事法とも使用)や再生医療等安全性確保法が施行され、再生医療の承認に向けた法体系が確立された。特に、改正薬事法に導入された早期承認制度においては、これまで5~8年かかった臨床試験から承認までの期間が3年半と短くなった。また、再生医療等安全性確保法においては細胞培養加工の外部委託が認められたことも極めて画期的で、多くの海外企業がアライアンス等を通じて日本での事業開始を表明するなど、日本の再生医療を取り巻く環境は世界が注目するところとなっている。
<早期承認制度概要>
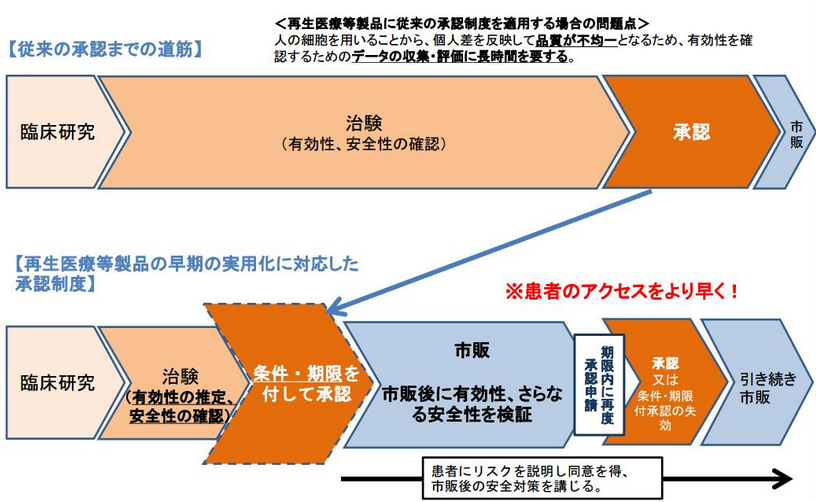
(厚生労働省資料より)
改正薬事法の下、2015年9月2日にテルモ(4533、東証1部)の重症心不全の病態改善のための骨格筋芽細胞シートが、同年9月18日にはJCRファーマ(4542、東証1部)の造血幹細胞移植後に発症する重篤な合併症に対する治療製品が製造販売の承認を受けた。どちらも申請から承認まで1年程度という短期間であった。
【1-5 事業内容とビジネスモデル】
主に脳神経に係る疾患である、慢性期脳梗塞、外傷性脳損傷、脳出血、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等のアンメットメディカルニーズの高い疾患を対象とした再生細胞薬の開発、製造、販売を手掛けている。
(1)再生細胞薬
①再生細胞薬とは
同社グループは上記疾患を対象とした再生医療において、「再生細胞薬」の投与による治療を目指している。
サンバイオの再生細胞薬は、患者自身の細胞の再生機能を高め、病気・事故等で失われた身体機能の自然な再生プロセスを誘引ないし促進させ、運動機能、感覚機能、認知機能を回復させる効能が期待される医薬品である。
②他家移植 対 自家移植
再生医療に使用される細胞としては、「自家(じか)移植」と「他家(たか)移植」の2種類がある。
「自家移植」は患者本人から細胞を採取して加工・培養し、元の患者に移植し、治療するもの。これには、移植細胞の生着と栄養分を送るための血液供給機構が必要となる。さらに必要に応じて調製、加工、培養される。
「自家移植」による再生医療としては、前述のテルモの骨格筋芽細胞シートがこれにあたる。
患者の大腿部より筋肉組織を採取。組織内に含まれる骨格筋芽細胞を培養してシート状にし、そのシートを元の患者の心臓表面に移植することにより、重症心不全の病態改善が期待できるというもので、培養する細胞は患者自身から採取する自家細胞のため、理論的には免疫拒絶反応がないことが特徴として挙げられる。しかしながら、自家培養であっても、培養に使用される材料によっては免疫反応が起こる場合もあるという。自家移植は一般的に、「細胞調製に時間と手間がかかる」、「個人間のばらつきが大きい」などの点が指摘される。
他方、「他家移植」の場合は、健康なドナーから採取した細胞を加工・培養して量産化する。一人のドナーから数千人分の治療薬を製造することが可能であるため、自家移植に比べて、より低コストで治療できる。「他家移植」は、安全性および免疫適合性の問題をクリアできれば、多くの疾患に対する再生医療としてより良い選択肢となる。
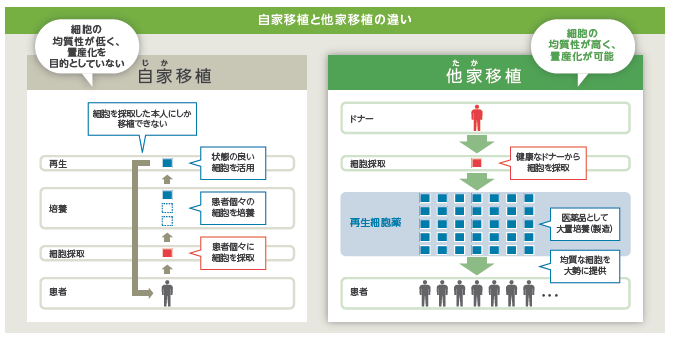
同社は「他家移植」の再生細胞薬を量産化し、「薬」として供給することを想定している。同社グループのミッション『再生細胞薬を用いて世界中のアンメットメディカルニーズの疾患を抱えた患者の治療・身体機能の改善に寄与する。』を実現するためには、「医薬品」として大量に生産し、既存の物流に乗せて世界中に届けることができる「他家移植」を採用している。
(2)再生細胞薬のラインアップ
現在は、「SB623」の慢性期の脳梗塞および外傷性脳損傷を対象とした開発が最も進んでいる。当面は、「SB623」の適応疾患拡大に注力する模様だが、将来的には、「SB623」のほか、「SB618」、「SB308」、「MSC1」、「MSC2」といった異なる機能を持った細胞薬の開発にも取り組み、パイプラインの強化を進めている。
再生細胞薬コード | 種類 | 適応疾患 |
SB623 | 神経再生細胞 | 慢性期脳梗塞、外傷性脳損傷、脳出血、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等 |
SB618 | 機能強化型間葉系幹細胞 | 末梢神経障害等 |
SB308 | 筋肉幹細胞 | 筋ジストロフィー等 |
MSC1 | 間葉系幹細胞 | がん疾患 |
MSC2 | 間葉系幹細胞 | 炎症性疾患 |
(3)再生細胞薬「SB623」
①「SB623」の効能
「SB623」は神経機能を再生する作用を持つ可能性を持つ治療薬で、体の自然な再生プロセスを促進させ、病気やケガで失われた運動機能、感覚機能及び認知機能の再生を目標としている。具体的な発現作用としては、①神経細胞をまもる、②神経細胞をつくる、③血管をつくる、④炎症を抑える等があり、これまでの研究によると、これらが複合的に作用することが示唆されている。
「SB623」の現在の中心的な対象疾患である脳梗塞は、脳の血管が詰まることで、その先の神経組織に栄養が届かなくなり、細胞が機能を失ったり死んでしまう病気である。脳梗塞は、発作後数時間までの急性期には血栓溶解剤も有効だが、それを過ぎるとリハビリ以外に対処方法はなく、さらに6~12か月を過ぎた慢性期に入ると多くの場合、リハビリによる改善効果も期待できないと言われる。
同社グループでは、米国で2011年から慢性期の脳梗塞患者に対して、2年間の「SB623」の安全性と有効性を確認するためのフェーズ1/2a臨床試験(フェーズ1とフェーズ2の一部を同時に行い、再生細胞薬の安全性と有効性を同時に確認したため、フェーズ1/2aとしている。)を実施し、2014年2月に最後の投与患者の投与後6か月の効果測定が完了した。この結果、副作用は認められないこと(安全性)、脳梗塞患者の運動機能が改善したこと(有効性)が確認され、FDAの承認の下、2016年よりフェーズ2bを実施し、2017年12月に被験者の組入れを完了している。
(もう一つの対象疾患である外傷性脳損傷についても2018年3月に組入れ完了。)
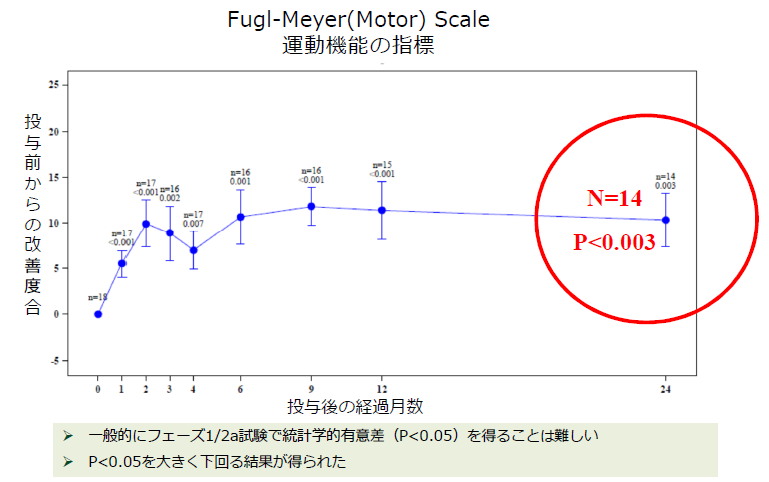
(同社資料より)
このグラフはフェーズ1/2aの臨床試験の結果の一部を、運動機能の効果を測定するための代表的な指標であるFugl-Meyer Motor Scale (フューゲルマイヤーモータースケール)で表したもの。横軸は「SB623」投与後の経過月数、縦軸は運動機能の改善度合いを示す。投与後月数が経過するほど機能改善が進んでおり、かつ効果が持続していることが分かる。
今回開示されたグラフでは、運動機能の改善が投与後24か月後も維持されていることが確認された。

(同社資料より)
投与前と投与後の機能改善例として、「車いすが必要な患者が歩けるようになった」、「動かなかった腕が上がるようになった」、「うまく話すことができなかった患者がスムーズに話すことができるようになった」等の事例が確認されている。下記リンクより、患者の改善の様子を動画で見ることが出来る。
https://www.youtube.com/watch?v=E4WXwhTp7Ow&end=215
②「SB623」の投与方法
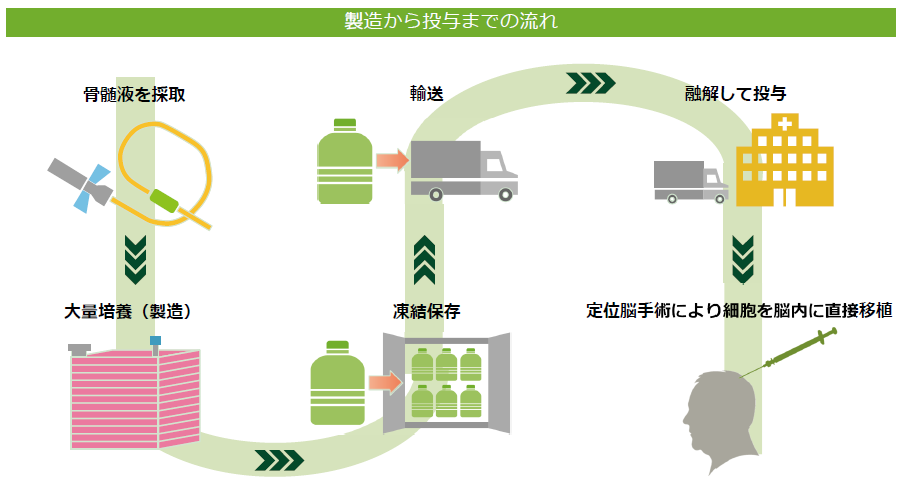
投与方法は、慢性期脳梗塞の場合、定位脳手術と呼ばれる既に脳神経外科では広く普及した手技により、局所麻酔で安全に投与される。
(同社資料より)
長期入院も不要で、米国における臨床試験では被験者は一日入院し、投与翌日には退院している。投与に当たっては免疫抑制剤も不要で、通常の医薬品と同様に、同一の製品を全ての患者を対象に使用することが可能である点も大きな特徴だ。
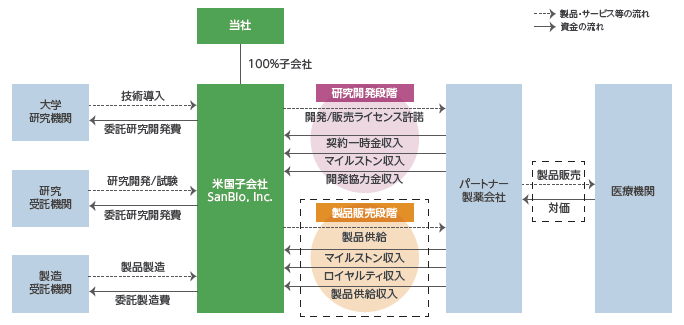
(3)ビジネスモデル
①概要
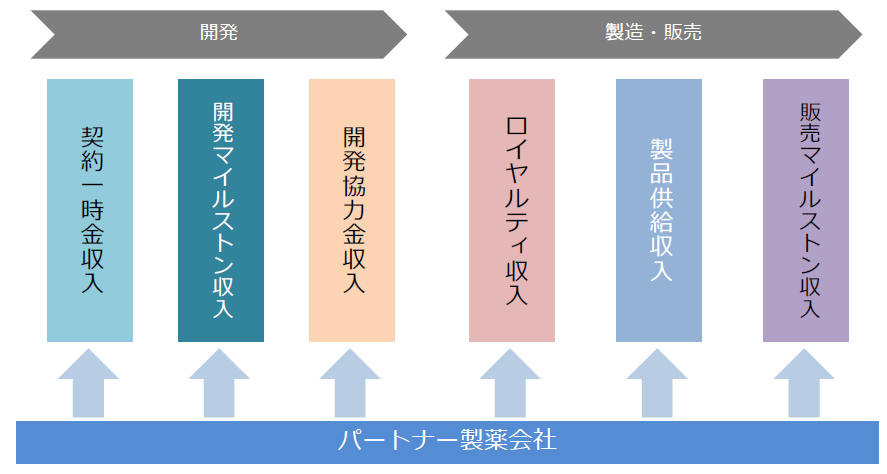
大学等の研究機関から技術を取得して同社が製造開発、非臨床試験、臨床試験を実施し、医薬品の販売網を有するパートナー製薬会社に開発権及び販売権をライセンス許諾する。契約に応じて、①契約一時金、②マイルストン収入、③開発協力金、④ロイヤルティ収入、⑤製品供給に係る収入等を得るビジネスモデルとなっている。
技術導入、研究開発・試験、製品製造については、委託先である大学等研究機関、研究受託機関、製造受託機関等に対し適宜委託費用を支払う。なお、ライセンス許諾については、ヒトでの安全性と有効性を確認する段階まで自社で開発を進めたうえで検討するとしており、製品価値の最大化を目指している。
(同社資料より)
収入形態 | 内容 |
①契約一時金収入 | ライセンス許諾の契約時の一時金として得られる収入。 |
②マイルストン収入 | 開発進捗に応じて設定したいくつかのマイルストンを達成するごとに一時金として得られる収入。上市後は予め設定した売上マイルストンの達成ごとに一時金として得られる収入。 |
③開発協力金収入 | 開発費用のうち、ライセンスアウト先負担分として得られる収入。 |
④ロイヤルティ収入 | 製品売上のうち、ロイヤルティとして一定割合を得られる収入。 |
⑤製品供給収入 | 製品供給の対価として得られる収入。 |
*上記は、既存提携先の大日本住友製薬株式会社との間の契約を例に、いくつかの収入形態をまとめたもの。
収入は、開発段階においては、①契約一時金収入、②マイルストン収入、③開発協力金収入のいずれか、またはすべてで構成され、製品上市後は、売上マイルストンに関する②マイルストン収入、④ロイヤルティ収入、⑤製品供給収入が主な収入形態となる。④ロイヤルティ収入、⑤製品供給収入は製品売上の一定割合として支払われるため製品売上に比例して増加することとなる。
(同社資料より)
➁パートナー製薬会社との提携状況
北米における「SB623」の脳梗塞用途の開発、製造、販売についてはパートナー製薬会社として、大日本住友製薬株式会社と契約を締結している。
会社名 | 契約締結日及び 契約期間 | 対象地域 | 内容 |
大日本住友製薬株式会社 | ・2014年9月26日 ・契約締結日からSB623上市後20年間 | ・米国 ・カナダ
| ・SB623脳梗塞用途の開発・販売権をライセンス許諾。 ・開発費用は両社それぞれが一定割合を分担。 ・販売に係る費用は大日本住友製薬株式会社が全額を負担 ・契約締結時の契約一時金に加え、開発段階では、①契約一時金収入、②開発マイルストン収入、③開発協力金収入の合計額が収入となる。 ・製品上市後は、売上マイルストンに関する⑥販売マイルストン収入、④ロイヤルティ収入、⑤製品供給収入の合計額が収入となる見込み。 |
大日本住友製薬株式会社とは対価の受取条件については以下の様に取り決めている。
項目 | 内容 |
①契約一時金収入 | 契約時 6百万米ドル(受取済) |
②開発マイルストン収入 | ・フェーズ2開始時 10百万米ドル ・フェーズ3開始時 10百万米ドル ・フェーズ3開始から1年経過時14百万米ドル ・生物製剤承認申請承認取得時40百万米ドル 合計40百万米ドル |
③開発協力金収入 | サンバイオグループが負担する開発費総額の50%相当額 |
④ロイヤルティ収入 | 製品販売価格の17% |
⑤製品供給収入 | SanBio Inc.は大日本住友製薬株式会社に対して合意した定額単価で供給 |
⑥販売マイルストン収入 | 年間の純売上高に応じた収入 ・500百万米ドルを超えた場合 25百万米ドル ・10億米ドルを超えた時場合 100百万米ドル |
日本における脳梗塞プログラムについては帝人から権利の返還を受け同社単独で開発を進めることとなったように、自社の開発力も着実に向上していると会社側は考えている。
脳梗塞の米国・カナダ以外の国や地域における開発権・販売権や他の疾患に関する開発権・販売権については、単独・共同双方を視野に入れ、スピードを重視した最適な開発体制の構築を志向していく。
【1-6 特徴と強み】
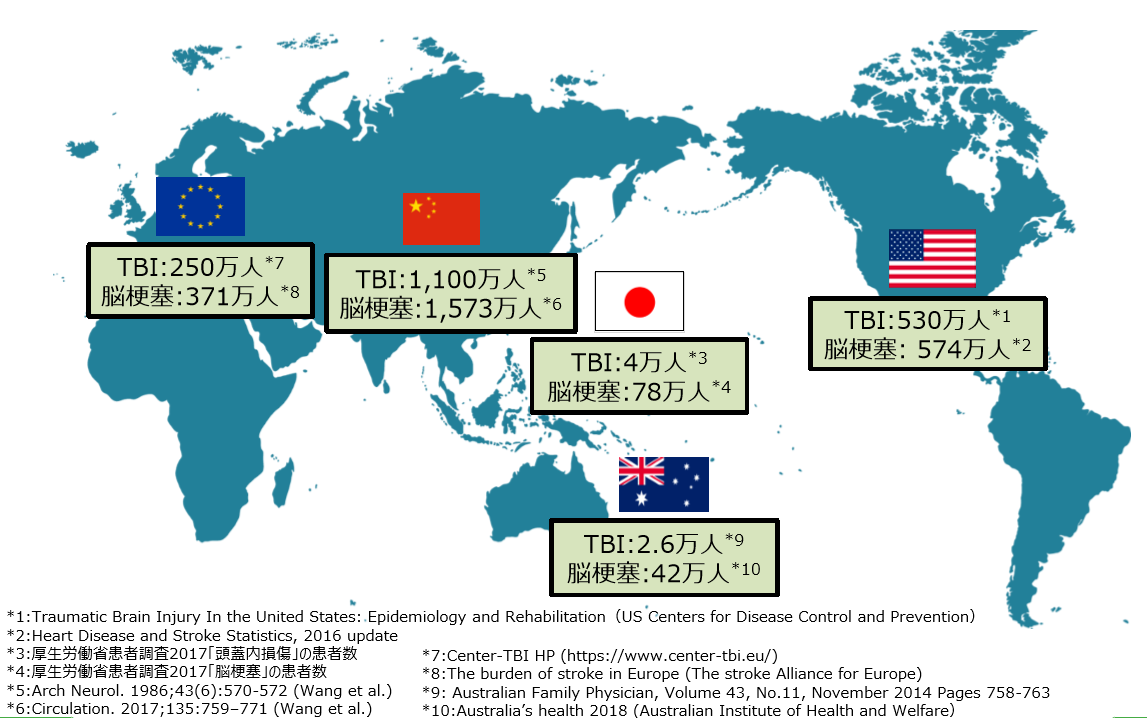
(1)巨大なターゲットマーケット
同社の再生細胞薬の対象となる疾患は、世界的に旧来の医療では対応できなかった中枢神経系領域が中心であるため、対象患者数が多いことが見込まれる。
同社の調べによれば、脳梗塞患者数は日・米・欧・中国・豪合計で約2,600万人。外傷性脳損傷で同約1,900万人。
(同社資料より)
この他、アルツハイマー病、パーキンソン病、加齢黄斑変性、網膜色素変性等、既存の医療・医薬品では対処できない多くの神経系疾患に対する再生細胞薬の有効性が広く認められれば、同社は世界的な巨大マーケットを開拓するとともに、多大な社会貢献を果たすこととなろう。
(2)競争優位性を高める特許戦略
開発及び製品販売に伴う収入の極大化を目指すため、再生細胞薬の開発に必要な知的財産を全て自社で取得することを特許戦略の基本方針としており、開発を進めている再生細胞薬(SB623、SB618、SB308)の基本特許は全て取得済みだ。
現在、以下の様に主要市場全てで基本特許を取得済みであり、地域ごとの特性を考慮して、自社単独もしくは有力なパートナー製薬企業との契約締結も検討しつつ、世界各地における臨床試験、製造開発、製品販売に向けた基盤の整備を進めていく考えだ。
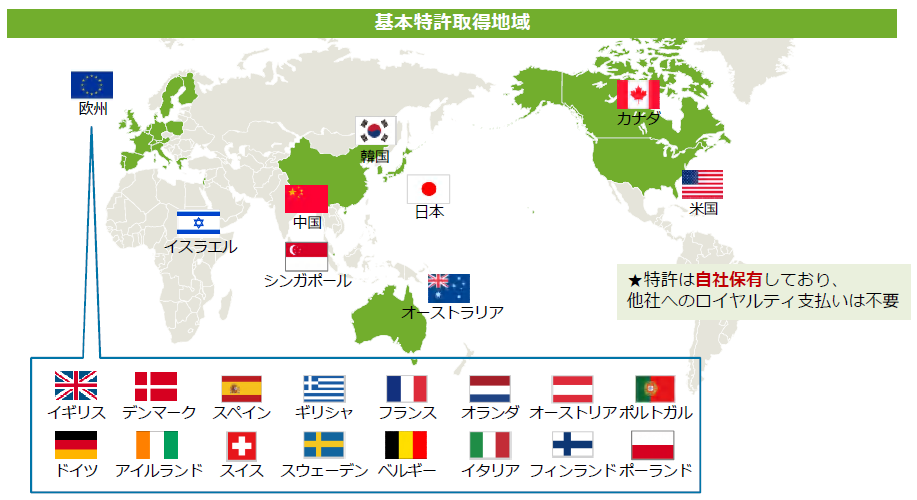
(同社資料より)
医薬品の特許には「物質特許」、「製法特許」、「製剤特許」、「用途特許」の4つがある。
このうち物質特許は物質そのものを保護する特許で、医薬品の特許のなかで最も重要で権利範囲の広い特許として取得に大きな費用と時間が必要になる。物質特許を取得できれば、開発した医薬品を独占的に製造・販売することができるため、同社グループでは「物質特許」の取得に最も力を注いでいる。
(3)製品供給権を確保
他社からライセンス導入して研究開発を行う創薬ベンチャー企業の場合、多くはパートナー製薬会社が製造を担い創薬ベンチャー自らが製品供給権を保有していないため、製品販売後の売上は製品販売に伴うロイヤルティ収入のみとなってしまう。
これに対し同社の場合、再生細胞薬は、他社からのライセンス導入品ではなく、基礎段階から自社で研究開発を行ってきた独自製品である。そのため、パートナー製薬会社との関係においては、再生細胞薬の製造を同社が担うため、製品販売後は製品販売に伴うロイヤルティ収入に加え、製品供給の対価として製品供給収入も獲得することが可能であり、収益源がより多角化している点も注目される。
(4)確立された量産化技術&再生細胞薬の安全性
再生細胞薬は、健常者ドナーの骨髄液から採取した細胞に、神経再生能力を高めるため遺伝子を導入(一過性)し、それを大量に増殖して作られている。
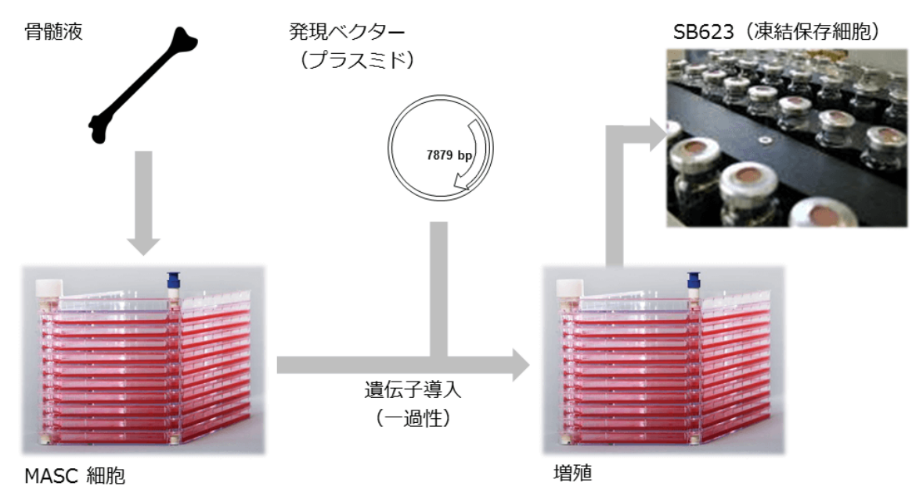
(同社HPより)
前述の様に、加工培養、製造、保存、輸送、投与までの技術は既に確立されており、製品販売後の量産に対応できる段階に達している点は同社の大きなアドバンテージとなっている。
また、倫理上の問題を指摘されるES細胞や、がん化リスクのあるiPS細胞に比べ安全性が高いと考えられる点からも、臨床現場から受け入れられやすいと想定できることも同社の差異化要因である。
2.再生細胞薬事業化の進捗
(1)開発
現在は、慢性期脳梗塞および外傷性脳損傷を対象とした「SB623」の開発が最も進んでいる。
当面は、「SB623」の適応疾患拡大に注力するが、今後は、「SB618」、「SB308」、「MSC1」、「MSC2」といった異なる機能を持った細胞薬の開発にも取り組み、パイプラインの強化を進めている。
*再生細胞薬の開発状況(パイプライン)

①慢性期脳梗塞プログラム
◎米国
2014年 | 6月 | 「SB623」のフェーズ1/ 2a臨床試験の結果を受けて、FDAから次のフェーズ2bの臨床試験実施承認を取得 |
9月 | 大日本住友製薬株式会社が先に締結したオプション契約を行使し、米国及びカナダにおける「SB623」の脳梗塞用途の共同開発をスタート | |
2015年 | 8月 | フェーズ1/2aの2年間の経過観察期間が終了 |
9月 | フェーズ2b へ進むに当たり、最初の治験施設との契約締結により共同開発パートナーである大日本住友製薬からマイルストン収入5百万米ドルを受領 | |
12月 | 「脳梗塞発症後6か月から90か月が経過した運動機能障害がある慢性期の患者」を対象にフェーズ2b(被験者数156名、二重盲検試験)の被験者募集を開始 | |
2016年 | 3月 | 最初の被験者の組入れを実施した、大日本住友製薬から5百万米ドルのマイルストンを受領 |
2017年 | 6月 | フェーズ2b試験に対しカリフォルニア州再生医療機構より、総額20百万米ドルの補助金を獲得。開発の進捗に応じて、補助金を受領し、2019年3月までに19百万米ドルを受領済。 |
12月 | 約3か月前倒しで予定(156名)を上回る163名の組入れを完了。経過観察および解析へ。 | |
2019年 | 1月 | 解析結果速報が公表。 投与6カ月後にFugl-Meyer Motor Scaleがベースラインから10ポイント以上改善した患者の割合(主要評価項目)について、SB623投与群は、コントロール群(SB623を投与せずSham手術を実施)と比較して、統計学的な有意差を示さず、安全性の問題は認められなかったものの主要評価項目を達成することができなかった。 |
フェーズ2b試験について主要評価項目を達成することができなかったものの、米国・日本・欧州・中国の4極グローバル展開を目指して米国での開発を継続することを決定している。
現在試験の詳細データを解析中で、大日本住友製薬と共に開発方針を検討中である。
◎日本
開発権及び販売権を帝人㈱にライセンスアウトしていたが、「SB623」に対する患者の期待の声がますます強まる中、両社協議の結果、開発および上市を更にスピードアップさせるためにはサンバイオが単独で取り組むことが適当であるとの判断に至り、2018年2月付で両権利がサンバイオに返還された。
サンバイオは独自開発の準備に着手し、日本の早期承認制度を利用して慢性期脳梗塞治療薬として世界中で最初の販売承認取得を目指している。
②外傷性脳損傷プログラム
「SB623」の疾患ターゲットとしては慢性期脳梗塞にとともに外傷性脳損傷用途の開発も着実に進んでいる。
外傷性脳損傷は、交通事故や転倒などで頭に強い衝撃が加わり脳が傷つくことによって起こる疾患で、半身の麻痺や感覚障害、記憶障害等の他、行動や感情のコントロールが困難になる高次脳機能障害といった深刻な後遺症が残る。改善を期待できる期間は脳梗塞よりもやや長いものの損傷後半年から1年程度にとどまり、それを超えると有効な治療法が存在しないとされている。
なお、米国で救急受診する患者数は年間約250万人で、後遺障害を抱える人の数は米国だけでも530 万人に上り、毎年28万人以上の新規患者が慢性的な障害に苦しんでいるとされている。
2015年 | 4月 | 外傷性脳損傷は、損傷部位や症状が脳梗塞に似ているほか、「SB623」の投与方法も同様であることから、「SB623」の適応疾患としてフェーズ1をスキップし、フェーズ2から治験を開始することでFDAと合意し、承認を取得 |
2016年 | 7月 | フェーズ2を「外傷性脳損傷受傷後12か月以上が経過した運動機能障害がある慢性期の患者」を対象とした日米グローバル治験として、日米約40施設で実施することとし、米国で最初の被験者の組入れを実施。 |
10月 | 日本で最初の被験者の組入れを実施 | |
2018年 | 4月 | 予定(52名)を上回る被験者数61名(二重盲検試験)の患者組入れを完了 |
11月 | 6か月の経過観察および解析期間を経て、2019年1月期中という会社側の予定通り、以下のような主要評価項目達成との解析結果を得る。
(解析結果) 日米グローバル第2相試験の主要評価項目Fugl-Meyer Motor Scaleにおいて、運動障害を伴う慢性期外傷性脳損傷患者にSB623を投与した群は、コントロール群と比較して、統計学的に有意な運動機能の改善を認め、主要評価項目を達成した。 24週時点のFugl-Meyer Motor Scaleのベースラインからの改善量は、SB623投与群で8.7点に対し、コントロール群では2.4点であった。 安全性についても、SB623のこれまでの試験の安全性プロファイルと一致しており、新たな安全性の懸念は認められなかった。 | |
2019年 | 4月 | 厚生労働省より、慢性期外傷性脳損傷を対象にした「SB623」が再生医療等製品として「先駆け審査指定制度」の対象品目の指定を受ける。 |
先駆け審査指定制度とは、2014 年6月に厚生労働省における「世界に先駆けて革新的医薬品等の実用化を促進するための省内プロジェクトチーム」において発表された「先駆けパッケージ戦略」に基づき新たに設けられた制度で、早期の治験段階で著明な有効性が見込まれる革新的な医薬品について優先審査するというもの。世界で初めて日本が制度化した。
今回の指定により、独立行政法人医薬品医療機器総合機構(PMDA)から薬事承認に係る相談・審査の優先的な取扱いを受けることが可能となるため、同社グループはこの利点を活かして、日本で2020年1月期(2019年2月~2020年1月)中に、国内の再生医療等製品に対する条件及び期限付承認制度を活用した再生医療等製品としての製造販売の承認申請を進め、加えて2021年1月期中の販売開始を目指している。
また、以下のような進捗も注目される。
2019年 | 4月 | 日米グローバルフェーズ2臨床試験(STEMTRA試験)の有効性及び安全性に関する詳細結果を、米国サンディエゴで行われた米国脳神経外科学会(American Association of Neurological Surgeons:AANS)の年次総会で発表し、良好な結果を公表。
(公表内容) このSTEMTRA試験では、SB623投与群46名、コントロール群15名の合計61名の被験者で行われ、主要評価項目はFugl-Meyer Motor Scale(FMMS)のベースラインからの改善量(運動機能障害の変化を測定するFMMSにおいて、10点以上の改善は外傷性脳損傷における臨床的に意味のある改善量とされる。)とし、その結果は、24 週時点のFMMSのベースラインからの改善量が、SB623 投与群8.7 点、コントロール群2.4 点となり主要評価項目を達成した。 また、10点以上の改善は、SB623投与群18名(39.1%)、コントロール群1名(6.7%)であったことから、統計学的な有意差が認められた。さらに、新たな安全性の懸念は認められなかった。
STEMTRA試験の結果はその後も、日本(4月、8月)、米国(8月)、中国(9月)等で開催されてた学会で公表され、世界でも類を見ない臨床試験結果が高く評価されている。 |
| 4月 | 欧州医薬品庁(European Medicines Agency:EMA)が「SB623」を、先端医療医薬品(Advanced Therapy Medicinal Product:ATMP)に指定
ATMPとは、遺伝子、組織、または細胞に基づいたヒト用の薬で指定についてはEMAの先進療法委員会によって決定される。ATMPの指定を受けた治療は、その病気や怪我の治療に対し画期的で新しい好機を提供する。 |
| 9月 | 米国食品医薬品局(U.S. Food and Drug Administration:FDA)が、「SB623」を「RMAT:Regenerative Medicine Advanced Therapy」の対象品目に指定
「RMAT」は米国21st Century Cures Act(21世紀治療法)のもとに設立された制度で、RMAT指定を受けた企業は、指定品目に関する優先審査と迅速承認の機会を得る。 |
こうしたSTEMTRA試験の結果や欧州・米国における指定を梃に、グローバルで外傷性脳損傷プログラムフェーズ3臨床試験を2021年1月期末までに開始する計画で、具体的な試験デザインや開発内容を現在検討中である。
◎慢性期脳出血プログラム
2019年1月、「SB623」の新規適応症として、慢性期脳出血プログラムを追加することを決定した。
脳出血は、血管が詰まって引き起こされる脳梗塞に対して、血管が破れることで引き起こされる疾患で、半身麻痺、感覚障害又は記憶障害等の症状が起こるが、現状では根治治療は存在していない。
同社では、慢性期脳出血は外傷性脳損傷と類似性があることから「SB623」の新規適応症として追加することとし、フェーズ2またはフェーズ3からの開始を見込んでいる。
◎加齢黄斑変性
「SB623」は強い神経保護作用を持つと考えられることから、網膜疾患への適応可能性が期待されている。
黄斑(おうはん)とは網膜の中央にあり、ものを見るために一番重要な部分。ものの形、大きさ、色、立体性、距離などの光の情報の大半を識別している。加齢とともに徐々に網膜の細胞が死滅する結果、視力が低下したり、ものの見え方に支障が出るのが加齢黄斑変性症である。そのなかでも患者数の多いドライ型については、根本的な治療法が存在しない。
患者数が多く、新たな治療法の確立が待たれている同疾患に対して、同社は、特に加齢黄斑変性(ドライ型)および網膜色素変性をパイプラインに入れ開発を進めている。
同社では、網膜変性の動物試験(非臨床試験)の結果をもとに、2014年1月に、FDAとINDミーティング(新薬の臨床試験申請前の情報提供)に向けた事前ミーティングを実施した。現在は今後米国で臨床試験を実施するために必要な非臨床試験の追加データについて準備を進めている。
◎がん疾患、炎症性疾患
開発品の拡大を目指し、2018年9月、間葉系幹細胞由来の細胞治療薬に関する特許ポートフォリオを取得した。
間葉系幹細胞(※)の細胞膜上に存在する特定の Toll 様受容体(※)を刺激することで、間葉系幹細胞の特徴である安全性及び忍容性を維持したまま抗炎症機能を増強する技術及び炎症機能を増強する技術に関するもの。
この技術により得られる抗炎症機能を増強した細胞「MSC2」及び炎症機能を増強した細胞「MSC1」は、通常の間葉系幹細胞と比較して、高い安全性と有効性が期待できる。
高い抗炎症作用を有する「MSC2」は、視神経炎、多発性硬化症やクラッベ病といった脱髄疾患、糖尿病性神経障害、関節リウマチ、クローン病等の炎症性疾患に対する治療薬として、炎症機能を高めた「MSC1」は、通常の間葉系幹細胞が腫瘍の成長に促進的に働くのに対し、腫瘍の成長を減衰させることが非臨床試験で確認されており、がん治療薬としてそれぞれ開発が期待できる。「MSC2」では各疾患モデル動物での非臨床試験が進んでいる。
※間葉系幹細胞
自己再生能力をもつ多能性細胞。骨細胞、心筋細胞、軟骨細胞、腱細胞、脂肪細胞など、間葉系に属する細胞への分化能をもつ。
※Toll 様受容体
外因性の危険信号(細菌やウイルスなどの構成成分など)や内因性危険信号(組織障害に伴い放出されるタンパク質など)を認識する受容体で、主にマクロファージや樹状細胞などの自然免疫系の細胞膜に存在する。ヒトでは現在までに、認識する構造が異なる10種類のTLRの存在が確認されている。
(2)製造・販売体制
今後の事業化を見据えて、製造・流通・販売体制構築をスピーディーに推進中である。
①量産化体制
再生細胞薬の実用化にあたっては、まず初めに量産化技術の確立がカギを握るが、サンバイオはすでにその点をクリアしている。
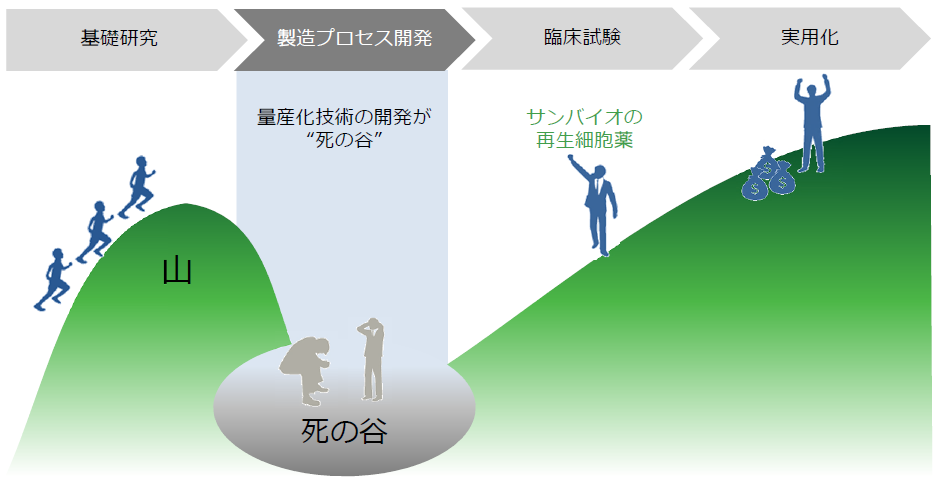
(同社資料より)
製造責任者であるマイク・マクグローガン氏は、前職において世界で初めて再生細胞薬の量産化に成功しFDAの治験承認を獲得した実績のある人物。
同氏は、サンバイオにおいて10年かけて治験実施とその後の販売に必要な量産技術の確立を成し遂げた。その量産技術は、他社の追随を許さないサンバイオ独自のものである。
加えて2017年9月には、テクニカル・オペレーション担当として、モハンマド・エル・カレイ博士を迎え、市販に向け、製造プロセスの開発、製造、サプライ・チェーン、品質管理、品質保証の体制を順次整えている。同博士は、細胞治療の分野では開発から製造まで幅広い知識と経営を有する業界屈指の人物。直近では、StemCells, Incでプロセス開発と製造の責任者を務めていた。
再生医療関連企業で量産化まで技術を確立できている企業は非常に少ない。従来の薬に比べて構造が複雑なものを取り扱う再生医療ビジネスにおいては、実用化に至るまでに長い年月が必要で「量産化」という超え難い「死の谷」が存在する。同社は、その「死の谷」をすでに超えているという点で、他社を大きくリードしていると言えよう。
「SB623」の臨床試験が着実に進展する中、2018年3月には日立化成株式会社(4217、東証1部)グループと「SB623」の製造に関する業務提携を締結した。
日立化成の子会社で再生医療等製品の受託製造事業を行うHitachi Chemical Advanced Therapeutics Solutions, LCCが保有する製造施設で、日本と米国市場向けに「SB623」の後期臨床試験用及び市販用製品を製造する。
②流通及び販売体制
流通・販売体制についても承認・上市を見据えた体制構築が進んでいる。
再生細胞薬は医療機関にとっても流通業務を含む医療周辺企業にとっても取り扱いに未経験の事項が多く、製品特性に適した普及準備への動きを加速する必要がある。
このような状況下、サンバイオ株式会社、株式会社ケアネット(東証マザーズ、2150)、株式会社メディカルインキュベータジャパン(非上場)、株式会社バイタルケーエスケー・ホールディングス(東証1部、3151)、株式会社アステム(非上場)の5社は、再生細胞薬「SB623」の適正使用・普及、安定流通を図るために業務提携を締結し、共同研究をスタートさせることとした。
再生細胞薬の適正使用・普及に向けた研究は、サンバイオ、ケアネット、メディカルインキュベータが中心となり実施。流通の在り方の検討及び研究は、サンバイオ、バイタルケーエスケー・ホールディングス、アステムが中心となって実施する。
また、業務提携をより実効性のあるものとするために資本提携も実施する。
加えて、厳格な品質管理、安定した製品供給、トレーサビリティの的確な管理など、再生医療薬をより安心・安全なものとするために株式会社スズケン(東証1部、9987)と流通に関する基本契約を締結したほか、患者サポートシステム「R-SAT」の共同開発にも着手した。
販売に関しては、バイオベンチャーの中で自社販売体制を構築している企業は数少ないが、売上・利益の最大化を追求するとともに、「SB623」を患者に適切・的確に届けることが自社の社会的責任であると考え、国内自販体制構築に向けて経験豊富な以下3名のキーパーソンを中心に体制を強化している。
役職・氏名 | 経歴など |
執行役員 事業部長(日本・アジア) 山本 寛氏 | エーザイ株式会社で国内営業およびアジアにおける事業戦略・マーケティングを担当後、アッヴィ合同会社で脳神経領域(パーキンソン病)の新薬上市に従事。参天製薬株式会社でASEAN地域事業の立ち上げおよびマネジメント、中国事業の統括など、日本・アジアにおける豊富なビジネス経験を有す。 |
メディカルディレクター、開発部長 金子 健彦氏 | 医師としての経験を活かし、ブリストルマイヤーズ株式会社でメディカルアフェアーズ、ファイザー株式会社、Pfizer Inc.(米国)及びノバルティスファーマ株式会社で多様な疾患の臨床開発業務経験を有す。 |
生産部長 津村 治彦氏 | 協和キリン富士フイルムバイオロジクス株式会社生産企画部長、同社生産開発センター長、協和発酵キリン株式会社バイオ生産技術研究所主任研究員などを歴任。 バイオ医薬品の製造、開発、教育において幅広い経験を持つ。 |
③グローバルリーダーを目指した体制づくり
米国子会社SanBio Inc.のCEOに招聘した辻村 明広氏の下、SB623の価値最大化を目指し、グローバル展開を進めている。
辻村氏はニチメン株式会社(現双日株式会社)で海外における企業経営に関する幅広い経験を積んだほか、参天製薬株式会社で販売ライセンス契約の締結、M&A、海外展開の実行など製薬企業においても豊富なビジネス経験を有しており、同社グループのグローバル戦略を強力に牽引することが期待されている。
辻村氏をリーダーに、チーフ・メディカル・オフィサー:ジャン・ネジャドニク医師、シニア・アドバイザー:ダミアン・ベイツ医師、事業部長(日本・アジア):山本 寛氏、開発部長:金子 健彦氏、マーケティング・シニア・ディレクター:マイケル・ガイサー氏など、製薬業界・再生細胞薬分野で世界的な経験・実績を積み各地域での開発や商業化に精通した人材を配置し、グローバルリーダーを目指した組織構築を推進中である。
3.今後の事業目標と目指す姿
(1)2020年「製薬企業への脱皮」~2025年「グローバルリーダーへの成長」
2018年11月、外傷性脳損傷を対象としたフェーズ2において主要評価項目を達成した同社は、当初予定通り日本において今期2020年1月期中(2019年2月~2020年1月)の条件付き早期承認制度への申請を行い、「SB623」として最初の販売承認取得を目指している。
承認取得及びその後の販売を見据え、前述のように製造体制および国内自販体制構築を進めており、来年2020年を、従来の研究開発ステージから再生細胞薬を販売する「製薬企業へ脱皮する年」と位置付けている。
続けて、外傷性脳損傷については日本以外、米・欧・豪等グローバルでのフェーズ3を来期中に開始し「地域拡大」を図る。
加えて、前述の通り日立化成との提携のほか、国内外で豊富な経験と実績を有する人材を確保するなど、開発・製造・流通・販売のための事業基盤構築は着実に完成に近づいている。
SB623の価値最大化を達成するためのグローバルローンチの実現、グローバル製品供給体制の確立と、開発品の導入やM&Aによるパイプラインの強化を図り、2025年にはグローバルリーダーへと成長することを目標としている。
(2)目指す姿
現在注力している慢性期脳梗塞および慢性期外傷性脳損傷の開発実績を上げるとともに、「地域拡大」と「疾患拡大」を進め、「SB623」の価値最大化を図る。
また、「SB623」以外のパイプライン開発にも取り組み、日本発の再生医療グローバルNo.1企業を目指す。
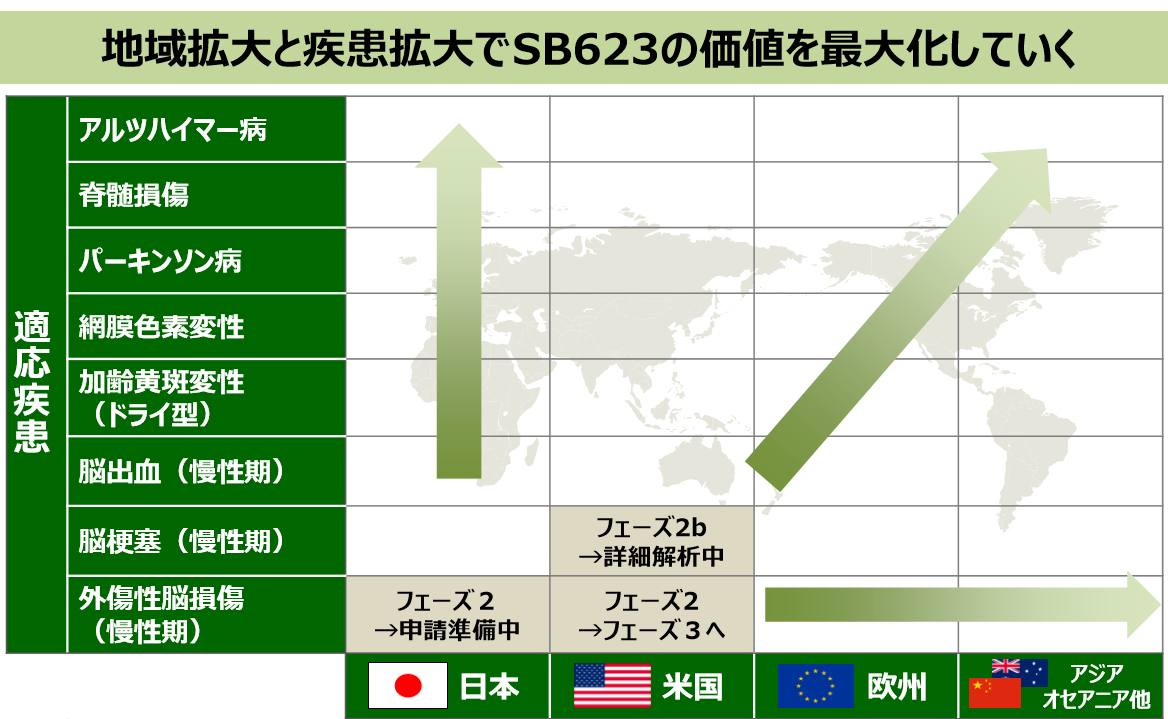
(同社資料より)
4.業績動向
(1)2020年1月期第2四半期決算概要
①連結業績概要
| 19/1月期2Q | 20/1月期2Q | 前年同期比 | 予想比 |
事業収益 | 415 | 427 | +12 | +143 |
事業費用 | 2,031 | 2,812 | +781 | -918 |
うち、研究開発費 | 1,669 | 2,013 | +344 | -1,465 |
営業利益 | -1,615 | -2,385 | -769 | +1,060 |
経常利益 | -1,040 | -2,039 | -999 | +1,157 |
四半期純利益 | -1,041 | -2,048 | -1,007 | +1,149 |
*単位:百万円
前年同期比増収・営業減益
事業収益は、前年同期比12百万円増の4億27百万円。内容は、北米において大日本住友製薬株式会社と締結している「SB623」の共同開発及び販売ライセンス契約による開発協力金収入など。
営業損失は同7億69百万円拡大の23億85百万円。研究開発費が同3億44百万円増の20億13百万円となった。
経常損失は同9億99百万円拡大の20億39百万円。営業外収益にカリフォルニア州再生医療機構(CIRM)からの補助金4億93百万円を計上したが営業外費用に為替差損1億8百万円を計上した。
期初予想に対しては、研究開発・製造関連費用の一部が期ずれにより下期の計上となったため損失は改善したが、開発は順調に進捗している。
②財務状態とキャッシュ・フロー
◎主要BS
| 19年1月末 | 19年7月末 |
| 19年1月末 | 19年7月末 |
流動資産 | 13,058 | 17,584 | 流動負債 | 1,066 | 466 |
現預金 | 12,453 | 16,732 | 短期借入金 | 33 | - |
固定資産 | 917 | 752 | 固定負債 | 4,000 | 4,000 |
有形固定資産 | 74 | 54 | 負債合計 | 5,066 | 4,466 |
無形固定資産 | 2 | 1 | 純資産 | 8,909 | 13,870 |
投資その他の資産 | 840 | 696 | 資本剰余金 | 13,143 | 11,786 |
資産合計 | 13,975 | 18,337 | 利益剰余金 | -13,675 | -5,908 |
*単位:百万円
2019年5月に実施した海外募集による新株式発行で現預金が増加。総資産は前期末に比べ43億円増加した。負債は同6億円の減少。増資に伴い繰越利益剰余金の欠損填補を行ったため資本金・資本剰余金が減少した一方、利益剰余金が増加し純資産は同49億円増加。この結果自己資本比率は前期末の63.5%から11.8%上昇し75.3%となった。
◎キャッシュ・フロー
| 19/1月期2Q | 20/1月期2Q | 増減 |
営業CF | -2,137 | -2,788 | -651 |
投資CF | -3 | -12 | -8 |
フリーCF | -2,141 | -2,801 | -659 |
財務CF | 11,493 | 7,036 | -4,457 |
現金同等物残高 | 13,932 | 16,732 | +2,800 |
*単位:百万円
税金等調整前当期純損失の拡大で営業FC、フリーCFのマイナス幅は拡大。
キャッシュポジションは上昇した。
(2)2020年1月期業績予想
*連結業績予想
| 19/1月期 | 20/1月期 予想 | 前期比 |
事業収益 | 741 | 713 | -28 |
事業費用 | 4,475 | 6,601 | +2,126 |
うち、研究開発費 | 3,712 | 5,195 | +1,483 |
営業利益 | -3,733 | -5,887 | -2,154 |
経常利益 | -2,919 | -5,390 | -2,471 |
当期純利益 | -2,920 | -5,395 | -2,475 |
*単位:百万円。予想は会社側発表
業績予想に変更なし。減収減益。国内自販とグローバル展開を進める。
業績予想に変更はない。研究開発費は前期比14億83百万円増加の51億95百万円。製造および国内自販体制などSB623の安定供給に向けた基盤整備のための投資が中心。
「2020年 製薬企業への脱皮」を目指し、国内での慢性期外傷性脳損傷適応での承認申請を行うほか、国内自販体制の構築、安定供給体制の基盤整備を進める。
また、「2025年 グローバルリーダーへの成長」のために、慢性期外傷性脳損傷適応でのグローバル試験開始、慢性期脳梗塞および慢性期脳出血適応での開発進行、グローバル展開のための適応拡大も含めたパイプライン強化に取り組んでいく。
(3)トピックス
①株式会社スズケンと再生細胞薬の流通に関する基本契約締結及び患者サポートシステムに関する共同開発を開始
2019年8月、医薬品卸大手の株式会社スズケンと再生細胞薬の商業化に向けた流通(物流及び商流)に関して、製品の安定供給を目的とした取引基本契約を締結した。
また、患者への投与までのトレーサビリティ及び投与後の患者へのサポートまでのトータル管理を可能とするシステム(R-SATシステム)を共同開発することについても合意した。
◎取引基本契約
今回の取引基本契約は、製品の売買における商流部分に関する契約だが、現在、製品の市場への出荷判定を行うための製造業及び製造工場から医療機関までの輸配送業務等の物流業務の受委託についても、契約締結に向けて協議を開始している。
◎R-SATシステム
(概要)
「Regenerative medicine:再生医療薬、Safety:安全性、Accurate:正確、Traceability:トレーサビリティ」というシステム名の頭文字からわかるように、医療機関からの製品受注に対して、出荷判定から全国の医療機関への配送と、患者への投与までの厳格な品質管理をタイムリーに確認することができるシステムである。
さらに、投与後の患者サポートのためのスケジュール等の管理も可能で、医療機関も再生医療薬をより安心・安全に利用できる体制が整うこととなる。
(メリット)
患者・医師・病院のメリット | 卸・メーカーのメリット |
製品が現在どこにあるのか、どのような経緯で病院に届くのか確認できる。
手術日を明確にし、手術室、細胞調整室、担当者等の役割分担を明確にする。
医師に対し市販後調査のリマインダーメールが送られ、患者の再受診日のリマインドなど手厚いフォローアップを行う。
開封されていない製品(使用されない製品、細胞)は返品が可能。 | 出荷記録の確認、製品のトレーサビリティを担保する。
手術日の確認とメディカルチームによるフォローアップ体制により症例に対して初めて投与する際の病院側の不安を和らげる。
返品体制を確立することで廃棄になる製品を限りなく減らすことができる。
投与後の患者のフォロー、市販後調査の抜け漏れを防ぐ。
再生医療のプラットフォームを築く。 |
2014年に施行された再生医療安全性確保法及び改正薬事法をきっかけとして日本は再生医療市場としての魅力が高まり、多くの海外製薬企業や国内外ベンチャー企業が日本市場へのアクセスを望んでいる。
そうした状況を踏まえ、同社では、R-SATシステムを単に自社製品のデリバリーを安全・的確に行うためのシステムとは考えておらず、日本において再生医療の事業化に取り組んできた同社が培ってきたメディカル、薬事、市販後調査などについての知見・ノウハウに加えてR-SATシステムを利用することで、多くの企業に日本市場へのアクセスを容易にする再生医療のプラットフォームとする考えだ。
②慢性期外傷性脳損傷を対象にした再生細胞薬SB623が米国食品医薬品局の「RMAT」の対象品目に指定
2019年9月、再生細胞薬SB623が、米国食品医薬品局(U.S. Food and Drug Administration:FDA)より「RMAT:Regenerative Medicine Advanced Therapy」の対象品目の指定を受けることとなったと発表した。
(RMATとは?)
2016年に施行された米国21st Century Cures Act(21世紀治療法)のもとに設立された制度で、RMAT指定を受けた企業は、指定品目に関する優先審査と迅速承認の機会を得る。
指定にあたっては、「再生医療の治療薬であること」、「重篤な疾患に対する治療薬であること」、「アンメットメディカルニーズがある重篤な疾患に対しての臨床試験において一定の効果を示した治療薬であること」という適用条件が設けられている。
指定品目に関する優先審査と迅速承認の機会を得ることができるという点では、Breakthrough Therapy(BT)指定と同様であるが、「再生医療の治療薬であること」、「アンメットメディカルニーズがある重篤な疾患に対しての臨床試験において一定の効果を示した治療薬であること」という条件から、RMAT指定はBT指定よりも数段ハードルの高い指定制度である。
(RMATの指定内容とそのインパクト)
「SB623」がRMAT指定を受けた概況およびそのインパクトは以下のとおりである。
* | FDAは、サンバイオグループが単独で慢性期外傷性脳損傷を対象とした日米グローバルのフェーズ2臨床試験(STEMTRA試験)結果に基づいてRMATの指定を行った。 |
* | STEMTRA試験では、「SB623」の投与群はコントロール群と比較して、統計学的に有意な運動機能の改善を認め主要評価項目を達成し、安全性の懸念は認められなかった。 |
* | 外傷性脳損傷は、全世界で一般的な疾患の一つであり、長期化することや時に死をもたらすこともある。RMAT指定により、今後、サンバイオグループはアンメットメディカルニーズに対する臨床開発の加速についてFDAと緊密に連携することが可能となる。 |
* | RMAT指定は、FDAにおける創薬に関する主要な制度であり、「SB623」が薬として承認を受けるための強力な支持とその可能性を大きく高めている。 |
* | RMAT指定は、2019年4月に指定を受けた厚生労働省の「先駆け審査指定制度」に続くものである。 |
5.森社長に聞く
森社長にRMAT指定の意味するところ、再生医療プラットフォーム構想、今後注目すべきポイントなどを伺った。
Q:「SB623が米国食品医薬品局(FDA)のRMAT対象品目に指定されたことはどんな意味を持つのでしょうか?」
A:「SB623は優先的な審査実施に値するという高い評価を頂いたと考えていい。事業化に向けて大きな一歩を進めることができたという点を是非投資家の皆さんにご理解いただきたい。」
「SB623」のRMAT指定はおそらく日本企業では初めての事例であろう。米国では優先審査と迅速承認の機会を得ることができるという点では、Breakthrough Therapy(BT)という制度がRMATよりも前に作られたが、RMATは再生医療の治療薬にフォーカスした指定制度である。
RMAT指定は早期承認が決定したことを意味するわけではないが、政府が限られた予算や審査人員の中で優先的に審査を行ってくれるということで、それはとりもなおさず、多くの申請がある中で「SB623」が優先的な審査実施に値するという高い評価を頂いたと考えていいだろう。
RMAT指定を受けた製品数は正確には把握できないが、これまでの実績を見てみると、承認されるまでの時間が通常の半分程度に短縮されている。
RMAT指定によって当社は「SB623」の事業化に向けて大きな一歩を進めることができたという点を是非投資家の皆さんにご理解いただきたい。
Q:「スズケンと共同開発を進めているR-SATシステムの狙いはどのようなところにあるのでしょうか?」
A:「再生医療は患者だけではなく医療機関にとっても未知な部分も多いが、R-SATシステムを使う事で、医療機関も再生医療薬をより安心・安全に利用することができる。日本における再生医療の普及に大きく貢献することとなろう。ただ、当社ではR-SATシステムを単に自社製品のデリバリーを安全・的確に行うためのシステムとは考えていない。日本と米国の2極で再生医療薬の開発を進めているという強みを活かして、世界から日本へ、また日本から世界へつなげる再生医療のプラットフォーマーを目指していこうと考えている。」
R-SATシステムは、医療機関からの製品受注に対して、出荷判定から全国の医療機関への配送、患者への投与までの厳格な品質管理をタイムリーに確認することができるシステムで、投与後の患者サポートのためのスケジュール管理も可能だ。
例えば、本承認を得るためには極めて重要なステップである市販後調査については、多忙を極める医師がスケジュール通り実施できるように自動的にリマインドメールを送るといったような機能が盛り込まれている。
再生医療は患者だけではなく医療機関にとっても未知な部分も多いが、このシステムを使う事で、医療機関も再生医療薬をより安心・安全に利用することができる。日本における再生医療の普及に大きく貢献することとなろう。
ただ、当社ではR-SATシステムを単に自社製品のデリバリーを安全・的確に行うためのシステムとは考えていない。
早期承認制度のおかげで日本の再生医療市場は世界から注目されている。ただ、例えば海外のバイオベンチャーが日本での臨床試験実施を計画して日本当局と交渉しようとしても実際にはそう簡単に進めることは難しい。
そうした際に、日本において再生医療の事業化に取り組んできた当社はメディカル、薬事、市販後調査などについて豊富な知見やノウハウを備えており、R-SATシステムを利用することで日本市場へのアクセスのハードルを引き下げることができる。
また逆に、米国を始めとした海外において開発を行いたい、事業化に取り組みたいと考えている日本の大学や企業から当社が相談を受けるケースも増加している。
日本と米国の2極で再生医療薬の開発を進めている当社は世界的に極めてユニークなポジションを確立しており、この点を活かして、世界から日本へ、また日本から世界へつなげる再生医療のプラットフォーマーを目指していこうと考えている。
Q:「最後になりますが、今後注目しておくべきリリースやイベントはどんなものになるのでしょうか?」
A:「まずは、日本における外傷性脳損傷の今期2020年1月期中の承認申請、来期2021年1月期中の販売開始という計画の進捗に期待していただきたい。加えて、外傷性脳損傷のグローバルフェーズ3の開始と完了、米国における慢性期脳梗塞の今後の開発計画公表、適応疾患拡大のための途中結果、開発や事業化に関するアライアンスの公表など注目材料は多い。来年2020年に製薬企業へ脱皮した後、2025年にはグローバルリーダーへと成長することを目標とする当社をこれからも応援していただきたい。」
まずは、日本における外傷性脳損傷の、今期2020年1月期中の承認申請、加えて来期2021年1月期中の販売開始という計画の進捗に期待していただきたい。
加えて、同じく外傷性脳損傷のグローバルフェーズ3の開始と完了、米国における慢性期脳梗塞の今後の開発計画公表なども是非注目していただきたいと考えている。また、網膜色素変性・認知症・アルツハイマーといった適応疾患拡大のための仕込も進んでいるのでその途中結果も随時お知らせしたい。
来年2020年に従来の研究開発ステージから再生細胞薬を販売する製薬企業へ脱皮した後、SB623の価値最大化を達成に向けてグローバルローンチの実現、グローバル製品供給体制の確立、開発品の導入やM&Aによるパイプラインの強化を図り、2025年にはグローバルリーダーへと成長することを目標とする当社をこれからも応援していただきたい。
6.今後の注目点
慢性期外傷性脳損傷プログラムの開発に関し、日本における「先駆け審査指定制度」の対象品目の指定、米国脳神経外科学会における日米グローバルのフェーズ2臨床試験についての学会発表、欧州医薬品庁による「SB623」の先端医療医薬品指定に加え、米国FDAによる「SB623」のRMAT指定と、大きなトピックスが相次いでいる。
2020年1月期中の再生医療等製品としての製造販売の承認申請、2021年1月期中の慢性期外傷性脳損傷プログラムのグローバルフェーズ3臨床試験開始がまた一段と実現に近づいているようだ。また開発だけでなく、製品化後の量産・流通体制構築も着実に進んでいる。
一方で適応疾患拡大のための開発投資も今後は増加していくと思われ、そうした中でPLおよびCFがグローバルリーダーへの成長を目指す2025年あたりに向けどのような状況に向かうと会社側が想定しているのかも注目したい。
<参考:コーポレートガバナンスについて>
◎組織形態及び取締役、監査役の構成>
組織形態 | 監査役会設置会社 |
取締役 | 4名、うち社外1名 |
監査役 | 3名、うち社外3名 |
◎コーポレートガバナンス報告書
最終更新日: 2019年7月10日
◎基本的な考え方
当社は、コーポレート・ガバナンスの充実を経営の重要課題であると認識しており、内部経営監視機能の充実と適切な情報開示による透明性の高い経営を確保することで、経営環境の変化する中における永続的な発展と成長、持続的な企業価値の最大化に努めております。また、株主をはじめとするすべてのステークホルダーからの信頼を得るため、経営の健全性・効率性・透明性を確保すべく、最適な経営管理体制の構築に努めてまいります。
◎コーポレートガバナンス・コードの各原則を実施しない理由
当社はコーポレートガバナンス・コードの基本原則をすべて実施しておりますので、本欄に記載すべき事項はありません。
本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2019 Investment Bridge Co.,Ltd. All Rights Reserved. |


