ブリッジレポート:(7776)セルシード 2023年12月期決算
 橋本 せつ子 社長 | 株式会社セルシード(7776) |
 |
企業情報
市場 | 東証グロース市場 |
業種 | 精密機器(製造業) |
代表者 | 橋本 せつ子 |
所在地 | 東京都江東区青海二丁目5番10号 テレコムセンタービル |
決算月 | 12月 |
HP |
株式情報
株価 | 発行済株式数(期末) | 時価総額 | ROE(実) | 売買単位 | |
213円 | 31,459,019株 | 6,700百万円 | -51.4% | 100株 | |
DPS(予) | 配当利回り(予) | EPS(予) | PER(予) | BPS(実) | PBR(実) |
0.00 | - | -29.88円 | - | 68.08円 | 3.1倍 |
*株価は3/14終値。各数値は23年12月期決算短信より。
業績推移
決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 | EPS | DPS |
2020年12月 | 199 | -719 | -744 | -783 | -55.31 | 0.00 |
2021年12月 | 161 | -864 | -887 | -914 | -53.18 | 0.00 |
2022年12月 | 126 | -743 | -754 | -759 | -36.31 | 0.00 |
2023年12月 | 190 | -697 | -710 | -846 | -29.43 | 0.00 |
2024年12月(予) | 170 | -920 | -920 | -940 | -29.88 | 0.00 |
*予想は会社予想。単位:百万円。当期純利益は21年12月期までは親会社株主に帰属する当期純利益。21年12月期までは連結。22年12月期から非連結。
(株)セルシードの2023年12月期決算概要等についてご報告致します。
目次
今回のポイント
1.会社概要
2.2023年12月期決算概要
3.2024年12月期業績予想
4.今後の注目点
<参考:コーポレート・ガバナンスについて>
今回のポイント
- 23年12月期の売上高は前期比63百万円増の1億90百万円。細胞培養器材事業で海外売上が大幅に増加し、機材事業の過去最高売上を記録した。東海大学より自己軟骨細胞シートの製造を合計7症例受託し、受託事業も過去最高の売上となった。営業利益は6億97百万円の損失。増収効果により同45百万円の損失縮小となった。当期純利益は8億46百万円の損失。前期比86百万円の損失拡大。細胞培養器材事業資産にかかる有形固定資産の減損損失を計上したほか、セルシードが保有する関連会社株式について投資有価証券評価損を計上した。
- 24年12月期の売上高は前期比20百万円減の1億70百万円、営業損失は同2億22百万円拡大の9億20百万円の予想。
- 再生医療支援事業については、引き続き器材製品を中心に特に海外の販売の拡大を図る。再生医療に関わる総合的なサポートを通じて、再生医療の研究開発・事業化を支援する再生医療受託製造等も推進する。セグメント売上高1億70百万円を見込んでいる。
- 細胞シート再生医療事業においては同種軟骨細胞シートの開発を推進する。第3相試験については、現在、各治験実施施設での倫理審査(IRB)、治験実施契約締結を進めているが、手続きに時間を要しており、現時点では2024年の上半期中に被験者登録が始まる見通しである。また事業化の加速、将来の同種軟骨細胞シートの販売に向けて、引き続き複数の新規事業先候補とも積極的に交渉を重ねる。
- 細胞培養器材事業では、器材製品の拡販に向けた既存代理店との協業強化、2023年3月開催の第22回再生医療学会総会における付設展示会でのブース出展など、器材製品の積極的な販売促進活動の結果、特に海外売上が前年比大幅に増加し、器材事業としては過去最高の売上を記録した。24年2月には、高機能な幹細胞を簡便に分画し、無傷で細胞回収が可能な新製品VIVANT-CELL Pot with UpCell Plateの販売を開始しており、今後の更なる売上拡大を期待したい。
- 一方、投資家が注目する同種軟骨細胞シートについては、現在、各治験実施施設での倫理審査(IRB)、治験実施契約締結を進めているが、手続きに時間を要しており、当初は2024年12月期第1四半期と見込んでいた被験者登録開始は、現時点では2024年上半期中の見込みとのことである。こちらも早期のリリースを期待したい。
1.会社概要
【1-1 経営理念】
2016年、新たにミッション及びビジョンを策定し、再生医療の発展に貢献することをコミットした。
ミッション | 価値ある、革新的な再生医療をリードし、世界の医療に貢献します。 |
ビジョン | 細胞シートビジネスプラットフォームを確立して、最良の製品を世界に届けます。 |
【1-2 セルシードの再生医療】
失われた臓器や損傷あるいは機能が低下した臓器を再生して治療する新たな医療である再生医療。
東京女子医科大学の岡野光夫名誉教授・特任教授が開発した日本発・世界初の「細胞シート工学」を基盤技術とし、2つの事業を展開している。
一つは、同技術に基づいて作製した「細胞シート(シート状の培養細胞)」を用いた再生医療等、製品の開発を行う「細胞シート再生医療事業」。
もう一つが、細胞シートの基盤ツール(培養器材)である温度応答性細胞培養器材等の開発・製造・販売及び再生医療の研究開発・事業化を支援する再生医療受託サービスを提供する「再生医療支援事業」である。
「細胞シート工学」 - 再生医療の基盤技術 -
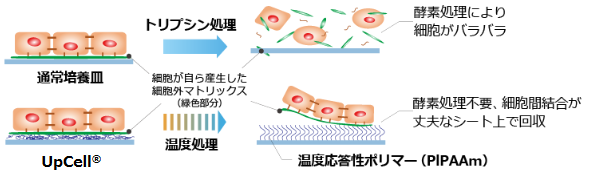
(同社資料より)
「細胞シート工学」は東京女子医科大学岡野光夫名誉教授が発明した日本発・世界初のプラットフォーム技術である。温度によって分子構造を変える性質を持つ温度応答性ポリマーで表面を加工した細胞培養皿「UpCell®」で細胞を培養する。細胞培養皿の表目は37℃で細胞が付着できる適度な疎水性(水分を弾く性質)になり、20℃では細胞が付着できない親水性(水分を含む性質)になる。このため、温度を変えるだけで、細胞外マトリックス(接着蛋白質)を保持したまま有機的に結合した「細胞シート」を培養皿から回収することができる。
一般に細胞は細胞外マトリックスを分泌し、自らを固定する事により増殖する性質を持つ。言い換えると、接着蛋白質を分泌しながら自らをどこかに固定しないと増殖できないのだが、従来の培養方法では、培養した細胞をトリプシン等の蛋白質分解酵素を用いて接着蛋白質を分解して回収していた(接着蛋白質を分解する以外に培養細胞の回収方法が無かった)。
巨大な再生医療マーケット
再生医療の市場規模は、2050年には国内市場2.5兆円、世界市場38兆円と予想され、今後極めて大きな経済効果が期待される。
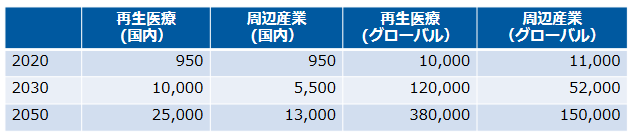
(同社資料より、単位:億円)
拡大する細胞培養器材市場
再生医療研究の進展と合わせ、近年は大量に培養した細胞を利用したバイオ医薬品の製造、細胞そのものを用いた免疫療法の開発、食料問題や環境問題の解決に向けた取り組みが盛んに行われている。
現在、一般的に使用される細胞回収技術であるタンパク質分解酵素の利用においては、細胞はダメージを受けた状態で回収され、細胞が有する本来の機能、成分を完全に維持する事が困難だが、同社の温度応答性細胞培養器材製品を導入する事により細胞を無傷で回収する事が可能となる。
これにより細胞本来が有する全ての機能、成分を維持したまま利用できるため、新規市場における産業面での効率や有効
性が大きく改善される可能性が注目されている。
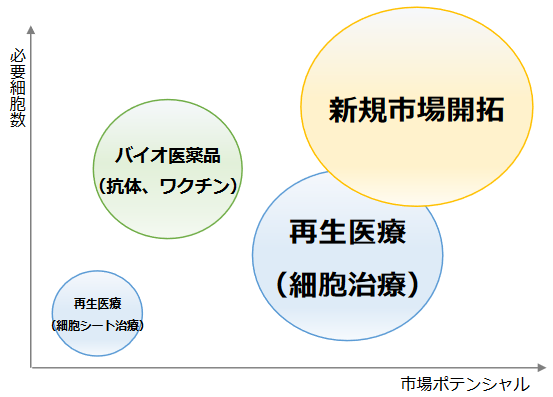
(同社資料より)
【1-3 セルシードのビジネスモデル】
細胞シートを使った大学の研究成果をシーズとして、同社が治験を行い再生医療製品として製品化し、患者に届けている。
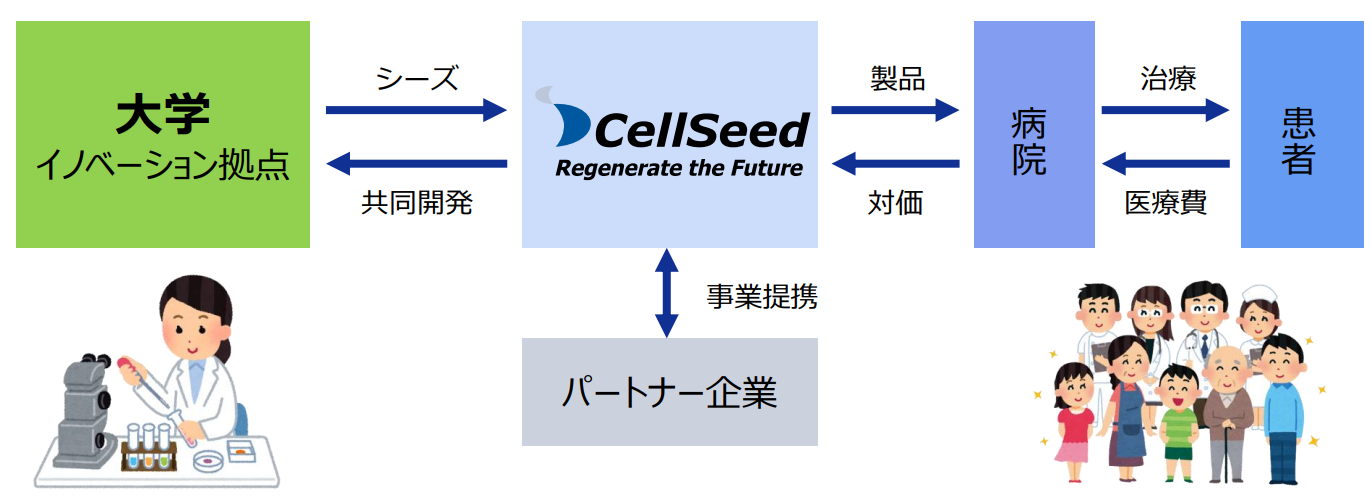
(同社資料より)
【1-4 事業内容】
(1)細胞シート再生医療事業
「細胞シート工学」を基盤技術とする治療の開発は様々な部位に用いられているが、同社では、膝軟骨の「同種軟骨細胞シート」に注力しつつ、中枢神経損傷関連疾患に対する新規治療について北海道大学との共同研究も進めている(「食道再生上皮シート」については、2023年11月、治験中止を決定している)。
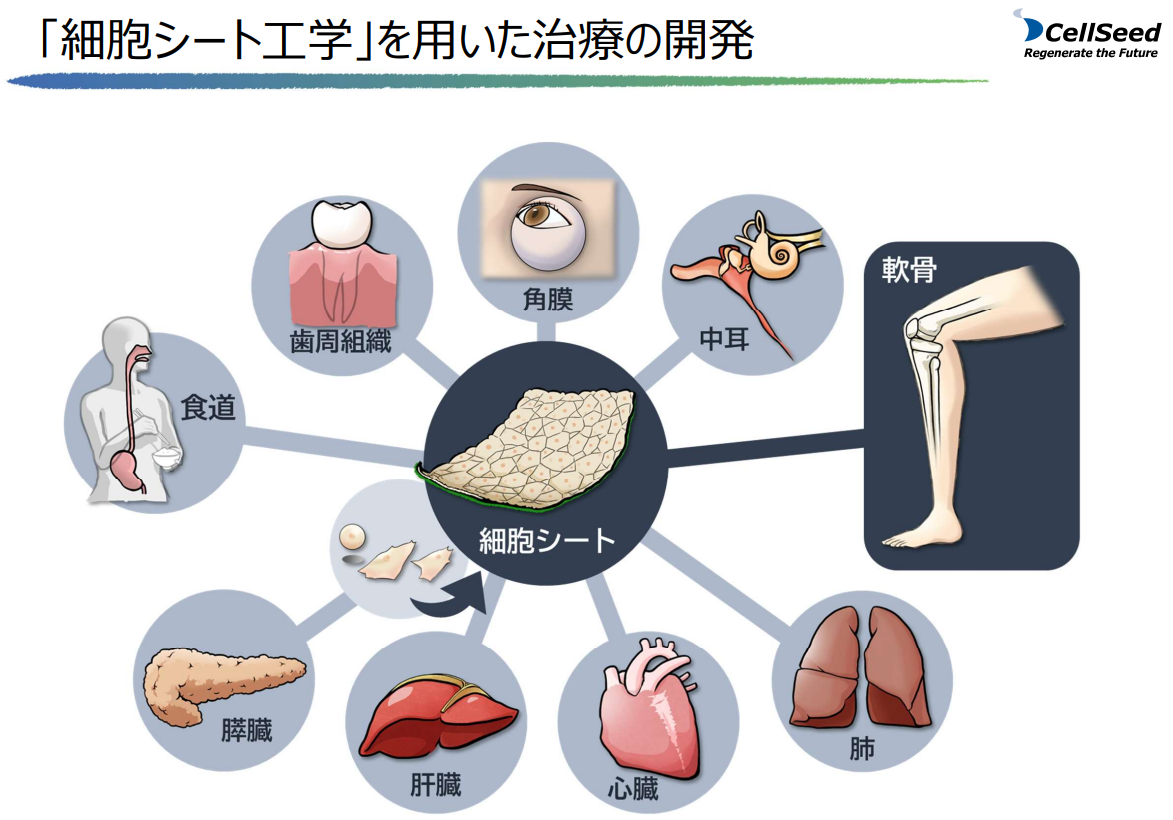
(同社資料より)
「同種軟骨細胞シート」
患者以外の細胞を基にした細胞シートである「同種軟骨細胞シート」は、東海大学整形外科 佐藤正人教授との共同研究であり、スポーツによる損傷や加齢を原因とする軟骨欠損や変形性関節症を適応症とする。
変形性膝関節症とは、緩徐に進行する難治性の関節軟骨変性で、根本治療がない。国内における患者数は潜在的に約3,000万人、そのうち自覚症状を有する患者数は約1,000万人と推定されている。また、高齢化により患者数の増加が予測され、国民健康寿命・介護費・医療費の観点から喫緊に対処すべき疾患であると言う。佐藤正人教授との共同研究は軟骨表面の根本的な再生を目的としている。膝の軟骨は、硝子(しょうし)軟骨と言い、耳や鼻等の軟骨とは異なり、クッション性と対摩耗性に優れた硬い軟骨で再生が難しい。しかし、共同研究を進めている「同種軟骨再生シート」は、硝子軟骨として膝の軟骨を再生できる事が臨床研究で確認されている。
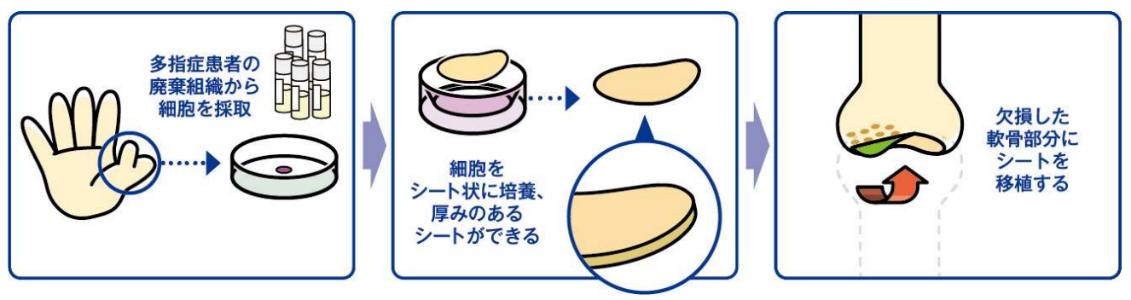
(同社資料より)
佐藤正人教授が2017年に世界で初めて移植手術を実施。2017年から2019年の3年間で10名の患者に移植手術を実施した。
同種軟骨シートによる治療は、AMED「再生医療の産業化に向けた評価化基盤技術開発事業(再生医療シーズ開発加速支援)」に採択された(事業期間:2018年10月~2021年3月)。
同種細胞による軟骨細胞シートの開発には、指が6本ある多指(趾)症患者の廃棄組織を使用するため、倫理上の課題を解決する必要があるが、2020年12月には国立成育医療センターより多指症患者から採取した軟骨組織提供の承認を取得した。
2021年7月には、国立研究開発法人日本医療研究開発機構(AMED)が公募した補助事業である「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)」に、セルシードが提案した研究開発課題が採択を受けた(事業期間:2021年8月~2023年3月)。
また、2022年8月には産業利用に対応した多指(趾)症手術時の切除組織の継続的な供給と事業化に向けた体制の構築を目的に、同医療センターと検体提供に関する契約の基本的事項について合意し、今後は同種軟骨細胞シートの治験および製造販売に向けて、原料となるヒト組織の供給を継続的に受けることが可能となった。
2022年4月には、日本において「組織再生培養細胞シート、製造方法及びその利用方法」に関する特許が特許査定となり登録された。
2023年1月には、東海大学の佐藤正人教授らの研究グループによって、変形性膝関節症の臨床研究において、膝関節の軟骨欠損部へ同種軟骨細胞シートを移植した患者10名の全例で、術後一年の安全性及び有効性が確認され、その研究成果がネイチャー姉妹誌の『npj Regenerative Medicine』(オンラインジャーナル)に掲載された。
加えて、2023年3月には上記AMED事業(再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業)の成果として、日本再生医療学会総会で発表する等、有効性についてのエビデンスを積み上げている。
一方治験開始までには、有効性に加え、安全性の確認や、細胞シートの品質管理及び輸送方法の確立等、品質の担保のための体制作りにも取り組んでいる。
組織から作成したセルバンクについては、細胞数、生細胞率、無菌試験、エンドトキシン試験、マイコプラズマ否定試験、ウイルス否定試験等を実施し、合計20項目の試験で安全性を確認しているほか、細胞シートについても細胞形態、シートの性状、タンパク質発現、ウイルス否定試験、染色体異常の有無の確認等10項目の試験を実施している。
これらの実績をベースに、同社では、2023年内に第3相試験(検証的試験)開始に向けた治験届の提出を予定していたが、9月20日、予定通り、治験届をPMDAに提出。その後、PMDAによる治験届の30日調査が終了した。
現在、各治験実施施設での倫理審査(IRB)、治験実施契約締結を進めているが、手続きに時間を要しており、現時点では2024年の上半期中に被験者登録が始まる見通しである。
(第3相試験概要)
*試験デザイン:多施設共同、単盲検、無作為化、並行群間の比較試験
*目標症例数:96症例
*対象患者:変形性膝関節症を有しており、脛骨近位骨切り術の適応となる患者
*主要評価項目:患者報告アウトカム(症状や QOLに関して、患者が自分自身で判定し、その結果に医師を始め他の者が一切介在しない評価方法)
*実施施設:東海大学医学部付属病院を含む全5施設(予定)
*食道再生上皮シートについて
2019年3月に治験を終了したが、統計的な優位性が証明されず追加治験が必要となった。その後、2020年10月に追加治験届を提出し、2021年2月には第1例目症例が登録され、ステロイド投与にリスクがある患者を対象に実施。並行して、PMDAから食道再生上皮シートの製造方法に対する改良の必要性に関する指摘を受け、対応を検討してきたが、PMDA と相談を重ねた結果、製造方法の改良には、製造方法変更前後の同等性の評価のために治験期間の延長が必要となる見通しとなり、これによる販売開始の遅れから事業性への懸念が生じた。
そこで、23年9月に治験計画届書を提出した同種軟骨細胞シート等、同社内での優先順位等を総合的に見直した結果、第3相試験の中止及び食道再生上皮シートの開発を中断することとした。
同社では、「現在、第3相試験に尽力いただいた医師の方々による食道再生上皮シートの医師主導治験や自由診療等の新たな治療創出に向けて協力して参る所存です。今後、公表すべき事項が生じた場合には、速やかに開示いたします。」とコメントしている。
(2)再生医療支援事業
細胞シート製品の製法開発・受託製造、施設管理・申請支援、コンサルティングを行う「再生医療受託事業」と、「UpCell®」「RepCell®」「HydroCell®」等の細胞培養器材等の開発・製造・販売を行う「器材事業」で構成されている。
①各事業内容
*再生医療受託事業
製薬会社・研究機関からの委託を受けて、主に細胞シートの受託開発・製造を行う。日本再生医療学会認定の臨床培養士が所属しており、培養の経験豊富なスタッフによる再生医療等製品の製法開発・製造を、特定細胞加工物の製造許可及び再生医療等製品製造業許可を受けた細胞培養センターで行っている。
一貫した品質及びサービスを提供するために、「ISO09001」の認証を維持しているほか、2017年3月に特定細胞加工物製造の許可(施設番号:FA3160008)を、2018年10月には再生医療等製品製造業許可をそれぞれ取得している。
加えて、製品の開発から製造販売に至るまでの各段階に応じた当局対応承認申請書作成、製造業・製造販売業許可取得支援、技術者の教育等を支援している。
再生医療受託サービスの主な受託案件実績は、歯根膜細胞シート、自己軟骨細胞シート、小児自己上皮細胞シート、細胞シート培養・剥離トレーニング等。
自己軟骨細胞シートは、再生医療等安全性確保法の法律の下で行われる先進医療Bとして2019年1月に承認され、2020年には東海大学が先進医療Bを開始。セルシードによる自己軟骨細胞シートの製造受託が始まった。2022年も引き続き受託している。
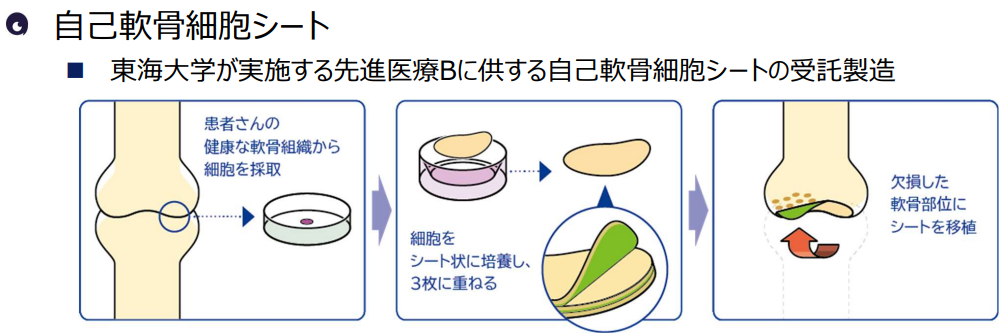
(同社資料より)
歯根膜細胞シートは、医師主導治験で用いる細胞シート受託製造の第1号案件である。
小児自己上皮細胞シートは、先天性食道閉鎖症術後の小児を対象としている。
2023年5月には、新たに、医療法人社団松和会 池上総合病院より、膝関節軟骨損傷に対する自己軟骨細胞シート移植に用いる細胞シートの製造を受託すると発表した。
池上総合病院は、再生医療等新規医療の取り組みの一環として、外傷や変形性膝関節症により膝関節軟骨に損傷がある患者を対象に自身の軟骨細胞をシート状に培養して膝関節の軟骨の傷んだ部分に貼りつけることで、痛みや関節機能を改善させることを目的とした再生医療を提供する。この再生医療は、東海大学医学部付属病院が実施する先進医療(自己細胞シートによる軟骨再生治療)の適応対象外の患者や海外からのインバウンドを対象に自費診療で実施するもの。
池上総合病院では、再生医療の実施に必要な提供計画を厚生労働省に提出し受理されたことを受け、患者の受け入れ体制の準備を進めている。
セルシードでは、自費診療領域に用いる細胞シートの製造受託による、受託事業の拡大に期待している。
再生医療においては、再生医療促進法の下、臨床研究・先進医療・自由診療によりアカデミアの研究開発を促す「再生医療等安全性確保法(安確法)」と、非臨床試験及び治験後の製造販売の承認取得の手続きを定めている「医薬品医療機器等法(薬機法)」が運用されているが、現実的には、アカデミアの研究開発と製造販売承認の間には大きなギャップが存在している。
同社は、再生医療受託サービスを通じてアカデミアが抱える課題、ギャップを解決し、再生医療を患者に届ける懸け橋になることを目指している。
*器材事業
1989年に東京女子医科大学の岡野教授が発明した温度応答性細胞培養器材は、温度を下げるだけで細胞を剥離することができるため、世界で初めて無傷な細胞シートを回収することを可能とした。
温度応答性細胞培養器材は世界中に販売され、多くの研究者により細胞シートを用いた治療法の研究・開発が盛んに進められている。
これまでも大学、研究機関、製薬企業等ユーザーのニーズに合わせ、様々な器材製品を開発・供給してきたが、2022年9月には新製品UpCell®フラスコ、製品の販売を開始した。
UpCell®は、温度応答性ポリマーを器材表面に固定し、細胞に損傷を与える酵素を用いることなく、無傷な細胞がシート状に回収可能な器材。
UpCell®フラスコは、従来のUpCell®ディッシュよりも培養面積を拡大した製品も販売予定で、ダメージを受けていない状態の細胞をより大量に回収が可能となり、免疫研究や細胞治療に関連する研究に最適である。UpCell®6ウェル用セルカルチャーインサートを用いた共培養等、生体環境に近い培養により、生体機能をより高いレベルで維持した細胞シートの回収が可能となる。
様々な感染症やがん疾患等の予防法や治療法を開発するための研究用細胞の大量培養を目的とした新たな需要の取り込みを期待しており、中長期的な事業の成長を見込んでいる。
2022年12月には温度応答性細胞培養器材製品 「UpCell® ADVANCE」 が、米国食品医薬品局(FDA)のメディカルデバイスマスターファイル(MAF)に登録された。
MAFは、供給メーカーが、企業情報、製造ノウハウ等の企業秘密や各種データをあらかじめFDAにMAFとして登録しておく制度。これにより、医薬品・医療機器等メーカーは、MAF番号を引用するのみで、FDAに販売承認申請することが可能となる。
MAF登録完了は、FDAによる、品質および安全性に関する確認または評価が完了したことを必ずしも意味するものではないが、医薬品・医療機器等メーカーが「UpCell® ADVANCE」を使用した製品についてFDAに申請する際に、セルシードに秘密情報の提出を求める必要がなくなるため、今回のMAF登録は「UpCell® ADVANCE」の普及に貢献するものとして期待される。
細胞培養技術者教育にも力を入れている。青海セルカルチャーイノベーションセンター内でUpCell®のユーザー向けトレーニングを行っており、実際に細胞シートの作製や細胞の剥離を行う際のコツ等をレクチャーしている。
②主要施設・設備
細胞培養センター
先進医療に使用される細胞シートは同社の細胞培養センターで培養(受託加工)している。
延床面積約763㎡で、自動モニタリングシステムによって、清浄度、室圧、温湿度、機器(培養器や保冷庫等)が自動管理され、監視カメラシステムも完備。また、羽田空港まで車で約20分と至近で空輸にも対応しやすい。

(同社資料より)
青海セルカルチャーイノベーションセンター
2021年9月より本格稼働を開始した。フラスコ製品の開発・製造等、細胞培養器材の開発・製造を行っている。
【1-5 成長戦略】
「細胞培養器材のビジネス拡大」と「世界展開に向けた事業提携推進」の2つを中心的な成長戦略としている。
(1)細胞培養器材のビジネス拡大
1989年東京女子医科大学の岡野教授が発明した温度応答性細胞培養器材は、前述のように、温度を下げるだけで細胞を剥離できるため、無傷な細胞シートを回収することが世界で初めて可能となり、多くの研究者により細胞シートを用いた治療法の研究・開発が進められている。
2020年に同社では、器材ビジネスとして初めて売上高が1億円を突破した。2021年9月には細胞培養器材製品専用の開発・製造施設を新設したほか、海外における器材製品拡販のアライアンス先である米国サーモフィッシャーサイエンティフィック社と販売契約を2025年まで延長することで両社合意した。
近年は大量に培養した細胞を利用してバイオ医薬品の製造や、細胞そのものを用いた免疫療法、更には食料問題や環境問題の解決に向けた取り組みが盛んに行われている。
ただ、現在一般的に使用される細胞回収技術であるタンパク質分解酵素では、細胞はダメージを受けた状態で回収され、細胞が有する本来の機能、成分を完全に維持する事が困難である。一方で、同社製品を導入すれば細胞を無傷で回収する事が可能となり、細胞本来が有する全ての機能、成分を維持したまま利用できるため、新市場における産業面での効率や有効性改善に大きく寄与するものと期待されている。

(同社資料より)
(2)世界展開に向けた事業提携推進
再生医療への応用を目的とした研究開発フェーズ向けへの製品販売が順調に拡大しているのと並行し、研究用細胞の大量培養を目的とした新たな用途での製品販売が海外を中心に急拡大している。
このため同社では、従来の再生医療市場における製品展開に留まらず、細胞培養器材新製品開発・製造施設の新設等、新市場のニーズを満たすソリューションを提供するための製品開発に注力中である。
2022年12月には温度応答性細胞培養器材製品 「UpCell® ADVANCE」 が、米国食品医薬品局(FDA)のメディカルデバイスマスターファイル(MAF)に登録された。
海外での販路をさらに拡大するべく、販売体制も強化している。前述のとおり、海外における器材製品拡販のアライアンス先であるサーモフィッシャーサイエンティフィック社と販売契約を延長し、連携を更に強化するほか、一貫した品質・サービスの提供と、より一層の顧客満足を充実させるため品質マネジメントシステムを構築し、2020年1月に国際規格であるISO9001:2015の認証を取得した。
このほか、世界展開に向け、Up Cell Biomedical Inc.設立(20年1月)、ベルリンで開催された「Translate! 2021 – Metrics and Milestones of Success」での講演(2021年1月)等、日本だけでなくアジアや欧州で開催されている展示会へ参加し事業提携を推進している。今後も各地で開催される展示会へ参加し事業提携先の獲得を目指す。
2.2023年12月期決算概要
【2-1 非連結業績】
| 22/12期 | 23/12期 | 前期比 | 予想比 |
売上高 | 126 | 190 | +63 | -9 |
売上総利益 | 61 | 107 | +46 | - |
販管費 | 804 | 804 | +0 | - |
うち、研究開発費 | 444 | 456 | +11 | - |
営業利益 | -743 | -697 | +45 | +142 |
経常利益 | -754 | -710 | +43 | +129 |
当期純利益 | -759 | -846 | -86 | -1 |
*単位:百万円。
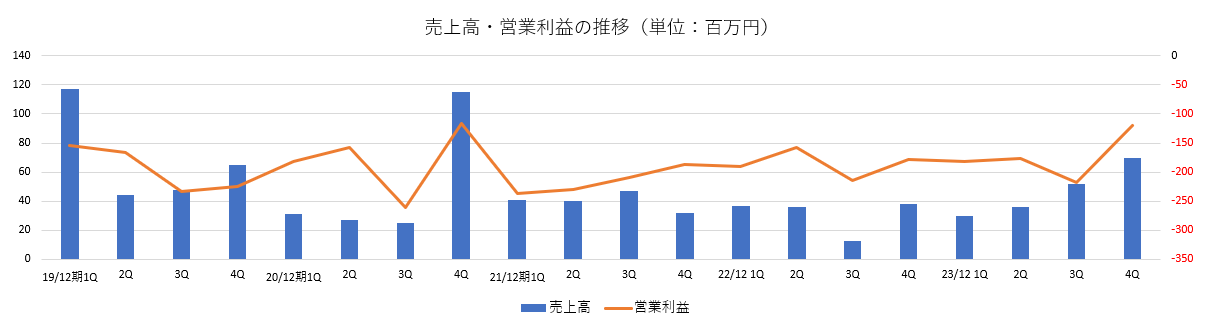
増収、損失縮小
売上高は前期比63百万円増の1億90百万円。
細胞培養器材事業で海外売上が大幅に増加し、機材事業の過去最高売上を記録した。
東海大学より自己軟骨細胞シートの製造を合計7症例受託し、受託事業も過去最高の売上となった。
営業利益は6億97百万円の損失。増収効果により同45百万円の損失縮小となった。
当期純利益は8億46百万円の損失。前期比86百万円の損失拡大。細胞培養器材事業資産にかかる有形固定資産の減損損失を計上したほか、セルシードが保有する関連会社株式について投資有価証券評価損を計上した。
【2-2 セグメント別動向】
| 22/12期 | 23/12期 | 前期比 |
再生医療支援事業 | 116 | 182 | +66 |
細胞シート再生医療事業 | 10 | 7 | -2 |
売上高 | 126 | 190 | +63 |
再生医療支援事業 | -90 | -32 | +57 |
細胞シート再生医療事業 | -462 | -468 | -5 |
調整額 | -189 | -196 | -6 |
営業利益 | -743 | -697 | +45 |
*単位:百万円。
再生医療支援事業
売上高は1億82百万円、営業損失32百万円(前期は1億16百万円の売上高、90百万円の営業損失)。
細胞培養器材事業では、器材製品の拡販に向けた既存代理店との協業強化、2023年3月開催の第22回再生医療学会総会おける付設展示会でのブース出展など、器材製品の積極的な販売促進活動の結果、特に海外売上が前年比大幅に増加し、器材事業としては過去最高の売上を記録した。
24年2月には、高機能な幹細胞を簡便に分画し、無傷で細胞回収が可能な新製品VIVANT-CELL Pot with UpCell Plateの販売を開始した。
今後は、主要販売代理店からの売上情報等の収集分析などにより、より慎重な判断のもとで既存製品の販売だけでなく、顧客ニーズ、市場動向に合致した新製品開発のための研究開発に注力し、新規顧客獲得を目指す。
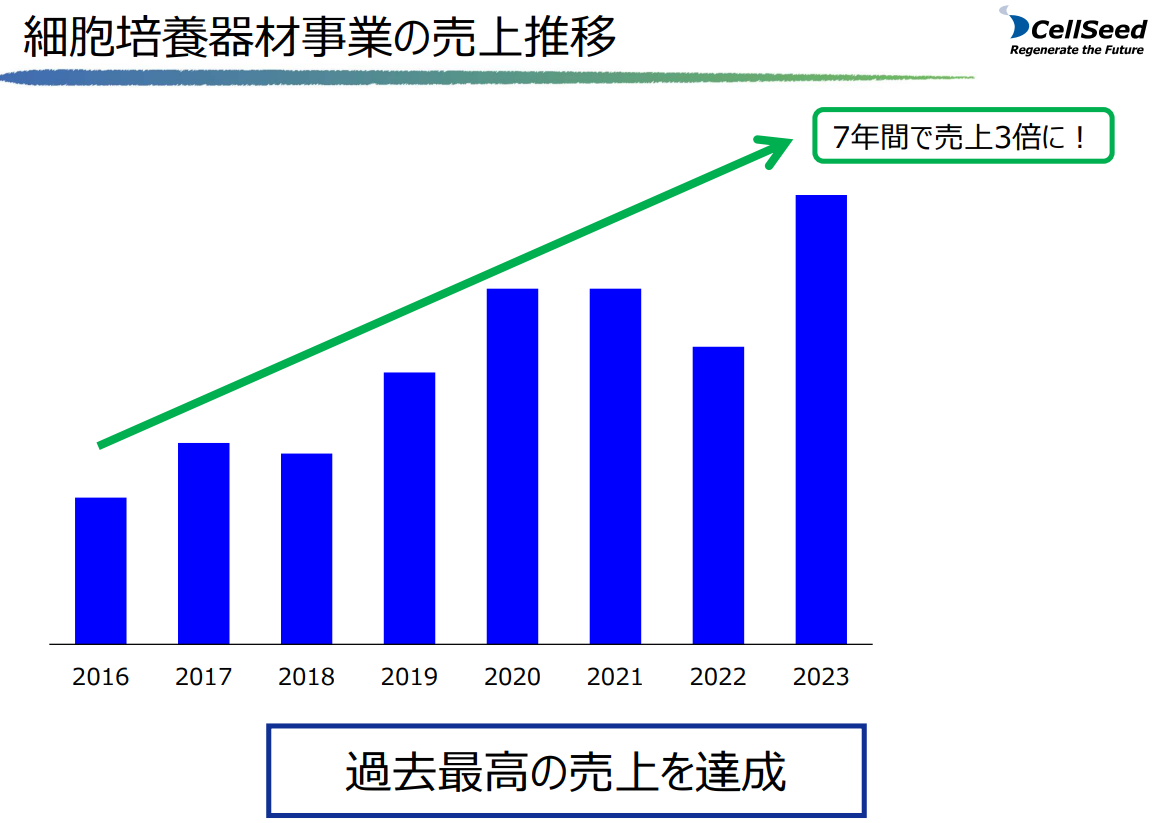
再生医療受託事業については、引き続き共同研究先である東海大学より先進医療にかかる自己軟骨細胞シートの製造を受託し、第1四半期(1-3月)に1症例、第3四半期(7-9月)に2症例、第4四半期(10-12月)に4症例を受託。年間合計で7症例受託した結果、受託事業においても過去最高の売上を記録した。
細胞シート再生医療事業
売上高は7百万円、営業損失4億68百万円(前期は10百万円の売上高、4億62百万円の営業損失)。
同種軟骨細胞シートについては、23年9月治験届提出後、PMDAによる治験届の30日調査が終了。現在、各治験実施施設での倫理審査(IRB)、治験実施契約締結を進めているが、手続きに時間を要しており、現時点では2024年の上半期中に被験者登録が始まる見通しである(第3四半期時点では、2024年12月期第1四半期と見込んでいた)。
事業提携活動については、事業化の加速、また将来の同種軟骨細胞シートの販売に向けて、引き続き複数の会社との事業提携及び共同研究契約の締結に向けた活動を積極的に行っている。なお、2023年12月公表のとおり、独占的事業提携契約を締結していた「三顧股份有限公司(MetaTech(AP) Inc.」と契約関係を解消したが、今後も、引き続き新規の提携契約獲得を目指している。
【2-3 財政状態】
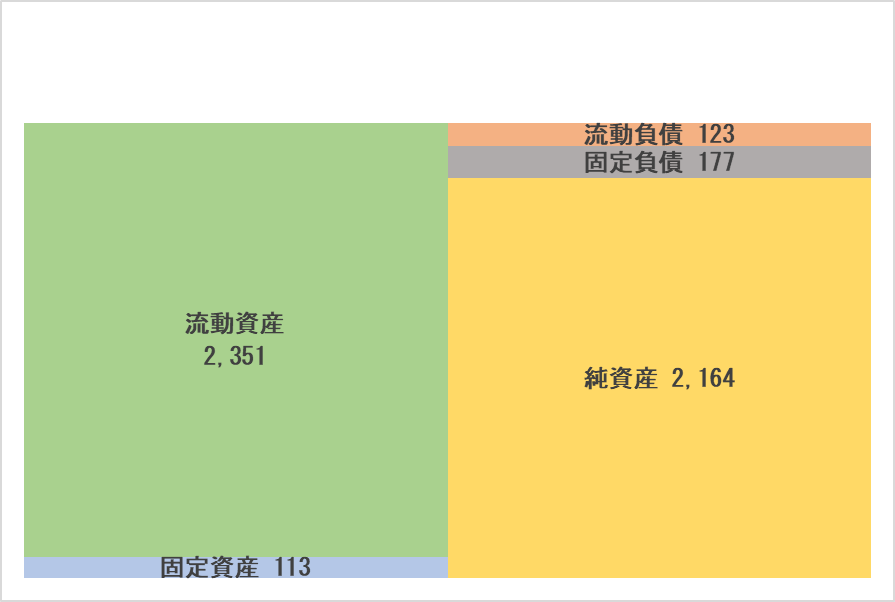
◎要約BS
| 22年12月 | 23年12月 | 増減 |
| 22年12月 | 23年12月 | 増減 |
流動資産 | 1,231 | 2,351 | +1,119 | 流動負債 | 180 | 123 | -57 |
現預金 | 1,072 | 2,163 | +1,091 | 短期借入金 | 7 | 7 | +0 |
売上債権 | 25 | 51 | +26 | 固定負債 | 184 | 177 | -7 |
たな卸資産 | 56 | 46 | -9 | 長期借入金 | 151 | 143 | -7 |
固定資産 | 311 | 113 | -198 | 負債合計 | 365 | 301 | -64 |
資産合計 | 1,543 | 2,465 | +921 | 純資産 | 1,178 | 2,164 | +986 |
*単位:百万円。 |
|
|
| 負債・純資産合計 | 1,543 | 2,465 | +921 |
*株式会社インベストメントブリッジが開示資料を基に作成。
新株予約権の行使による新株発行で、現預金が増加し資産合計は前期末比9億21百万円増の24億65百万円。
同様に、新株発行による資本金及び資本剰余金の増加、利益剰余金のマイナス額拡大により純資産は同9億86百万円増の21億64百万円。
自己資本比率は前期末から12.1ポイント上昇し86.9%となった。
◎キャッシュ・フロー
| 22/12期 | 23/12期 | 増減 |
営業CF | -718 | -779 | -61 |
投資CF | 61 | 56 | -5 |
フリーCF | -656 | -723 | -66 |
財務CF | 881 | 1,814 | +932 |
現金・現金同等物残高 | 1,072 | 2,163 | +1,091 |
*単位:百万円
新株予約権の行使に伴う株式の発行による収入の増加で財務CFのプラス幅は拡大。
キャッシュポジションは上昇した。
【2-4 トピックス】
(1)第3回細胞シート工学イノベーションフォーラムを開催
知名度及び日本発、世界初の「細胞シート工学」の認知度向上のため、2019年、2021年に続き、2023年11月に、同社主催で、第3回細胞シート工学イノベーションフォーラムを開催した。
全国から多数のアカデミア及び企業の参加があり、「細胞シート工学」やその周辺技術に関わる活発な議論が展開された。事業提携、協業、製造受託などの新たな取引先の開拓も期待できることから、2025年には第4回目の細胞シート工学イノベーションフォーラムを開催する予定である。
(2)三顧股份有限公司(MetaTech(AP) Inc.)との提携契約関係について
①提携契約関係を解消
23年12月、三顧股份有限公司(MetaTech(AP) Inc.)との提携契約関係を解消した。
(契約解消の経緯)
2017年に三顧股份有限公司(MetaTech(AP) Inc.)と細胞シート再生医療事業に関する台湾での独占的事業提携契約を締結し、事業提携を進めてきたが、2023年に入り、「細胞シート工学の情報が台湾において漏洩した」「MetaTech が同種軟骨細胞
シートの研究開発をしている」「同種軟骨細胞にかかる技術を中国へ流出しようとした」との現地報道があったことから、事実関係等に関して、セルシードとしての調査、加えて MetaTech に対する事実確認を続けてきた。
今般、セルシードの調査結果や事実確認に対する MetaTech からの回答の状況を踏まえ、MetaTech との間で締結済みの全ての契約関係を解消することとした。
(契約解消の影響)
セルシードは現在、日本国内での同種軟骨シートの開発、治験開始の準備を予定どおり進めており、引き続き提携先候補として、複数の国内外企業との交渉も継続している。
そのため、今回の契約解消による直接的な損害は限定的であり、特に同種軟骨細胞シートの開発にはほぼ影響はないと考えているが、今後新たな事象が発生し、業績に影響を与える開示すべき事項が発生した場合には、速やかに開示する。また、継続して上記の事実確認を行う考えだ。
②MetaTechが訴訟の提起
上記のセルシードによる提携契約関係解消に対し、24年2月、MetaTechがセルシードを相手取り、当該契約解消の無効を主張し、当該契約上の当事者の地位にあることの確認を求めて、東京地方裁判所に訴訟を提起した(セルシードによる訴状受領は24年3月7日)。
訴訟の目的の価額は548 万 5500 円。
セルシードは、MetaTech の訴えとは法的見解を異にしており、今後、訴訟において適切に対応していく。なお、今回の訴訟の提起が、セルシードの今期業績に与える影響は現時点ではないと会社側は判断している。
3.2024年12月期業績予想
【3-1 業績予想】
| 23/12期 実績 | 24/12期 予想 | 前期比 |
売上高 | 190 | 170 | -20 |
営業利益 | -697 | -920 | -222 |
経常利益 | -710 | -920 | -209 |
当期純利益 | -846 | -940 | -93 |
*単位:百万円。
増収、損失幅拡大
売上高は前期比20百万円減の1億70百万円、営業損失は同2億22百万円拡大の9億20百万円の予想。
<再生医療支援事業>
引き続き器材製品を中心に特に海外での販売拡大を図る。
また、再生医療に関わる総合的なサポートを通じて、再生医療の研究開発・事業化を支援する再生医療受託製造等を推進する。セグメント売上高1億70百万円を見込んでいる。
<細胞シート再生医療事業>
同種軟骨細胞シートなどの開発を推進する。この開発には引き続き研究開発費を要する見込み。第3相試験については、現在、各治験実施施設での倫理審査(IRB)、治験実施契約締結を進めているが、手続きに時間を要しており、2024年の上半期中に被験者登録が始まる見通しである。
またパイプラインの技術導出に向け新規事業先候補とも積極的に交渉を重ねる。
【3-2 継続企業の前提に関する重要事象等】
新株予約権の行使による資金調達の実施等により、23年12月末の手元資金(現金及び預金)残高は21億63百万円となり、財務基盤については安定的に推移している。一方で事業面においては細胞シート再生医療事業の重要課題である細胞シート再生医療第1号製品の早期事業化の道程を示すまでには至っていない。
以上のことから、同社では23年12月末において、引き続き継続企業の前提に重要な疑義を生じさせるような状況が存在していると判断している。
同社は当該状況の解消を図るべく、引き続き以下の施策に取り組んでいる。
細胞シート再生医療第1号製品の早期事業化の実現と事業提携の推進による収益機会の獲得
同社は、今後、同種軟骨細胞シートの開発を推進し、細胞シート再生医療第1号製品の早期事業化を実現すること、また事業提携先の開拓を通じて、更なる収益機会を獲得していくことで当該状況の解消を図る考えだ。
4.今後の注目点
細胞培養器材事業では、器材製品の拡販に向けた既存代理店との協業強化、2023年3月開催の第22回再生医療学会総会における付設展示会へのブース出展など、器材製品の積極的な販売促進活動の結果、特に海外売上が前年比大幅に増加し、器材事業としては過去最高の売上を記録した。24年2月には、高機能な幹細胞を簡便に分画し、無傷で細胞回収が可能な新製品VIVANT-CELL Pot with UpCell Plateの販売を開始しており、今後の更なる売上拡大を期待したい。
一方、投資家が注目する同種軟骨細胞シートについては、現在、各治験実施施設での倫理審査(IRB)、治験実施契約締結を進めているが、手続きに時間を要しており、当初は2024年12月期第1四半期と見込んでいた被験者登録開始は、現時点では2024年上半期中の見込みとのことである。こちらも早期のリリースを期待したい。
<参考:コーポレート・ガバナンスについて>
◎組織形態及び取締役、監査役の構成
組織形態 | 監査等委員会設置会社 |
取締役((監査等委員を除く) | 4名、うち社外3名(うち、独立役員1名) |
監査等委員 | 3名、うち社外3名(うち、独立役員1名) |
◎コーポレート・ガバナンス報告書(更新日:2023年4月7日)
基本的な考え方
当社は、技術革新と創造性を発揮し、質の高い優れた製品とサービスの提供を通じ、人々の健康と福祉に貢献していくことを使命とし、全ての企業活動において品質を高めるべく企業統治の整備を進めています。
今後につきましては、ディスクロージャーの透明性を高めるため一層説明責任を充実するとともに、さらなる経営のチェック機能強化を図ってまいります。
<コーポレートガバナンス・コードの各原則を実施しない理由>
当社は、東証グロース上場企業としてコーポレートガバナンス・コードの基本原則をすべて実施しております。
本レポートは、情報提供を目的としたものであり、投資活動を勧誘又は誘引を意図するものではなく、投資等についてのいかなる助言をも提供するものではありません。また、本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、当社は、本レポートに掲載されている情報又は見解の正確性、完全性又は妥当性について保証するものではなく、また、本レポート及び本レポートから得た情報を利用したことにより発生するいかなる費用又は損害等の一切についても責任を負うものではありません。本レポートに関する一切の権利は、当社に帰属します。なお、本レポートの内容等につきましては今後予告無く変更される場合があります。投資にあたっての決定は、ご自身の判断でなされますようお願い申し上げます。 Copyright(C) Investment Bridge Co. ,Ltd. All Rights Reserved. |
ブリッジレポート(セルシード:7776)のバックナンバー及びブリッジサロン(IRセミナー)の内容は、www.bridge-salon.jp/ でご覧になれます。
 | 同社の適時開示情報の他、レポート発行時にメールでお知らせいたします。 |
 | ブリッジレポートが掲載されているブリッジサロンに会員登録頂くと、株式投資に役立つ様々な便利機能をご利用いただけます。 |
 | 投資家向けIRセミナー「ブリッジサロン」にお越しいただくと、様々な企業トップに出逢うことができます。 |


