ブリッジレポート:(2183)リニカル vol.21
| (2183:東証1部) リニカル |
|
||||||||
|
||||||||
企業名 |
株式会社リニカル |
||
社長 |
秦野 和浩 |
||
所在地 |
大阪市淀川区宮原1-6-1 新大阪ブリックビル |
||
決算期 |
3月 |
業種 |
サービス業 |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2014年3月 | 3,721 | 706 | 703 | 449 |
| 2013年3月 | 3,599 | 1,003 | 998 | 616 |
| 2012年3月 | 3,110 | 728 | 723 | 424 |
| 2011年3月 | 2,512 | 288 | 278 | 147 |
| 2010年3月 | 2,404 | 480 | 473 | 273 |
| 2009年3月 | 2,036 | 549 | 515 | 300 |
| 2008年3月 | 1,273 | 505 | 494 | 296 |
| 2007年3月 | 613 | 186 | 195 | 114 |
| 2006年3月 | 118 | 16 | 19 | 11 |
| 株式情報(12/8現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
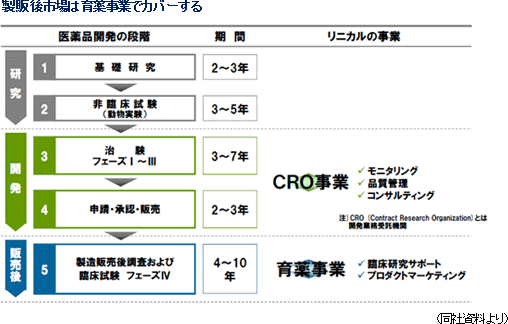
医薬品は発売前に厚生労働省の承認・認可を受けることが義務付けられており、承認前の薬剤(医薬品候補)を患者に投与して効果や安全性を確かめる必要がある。これら臨床試験としての治験を支援する企業をCRO(医薬品開発業務受託機関)と呼ぶ。製薬会社は開発要員に制限のある中で機動的な開発を遂行するために、業務をアウトソーシングする動きを拡大しており、CROの役割が大きくなっている。 同社は新薬開発に不可欠な治験の最も大切な段階である「第II相・第III相試験」と、主業務である「モニタリング業務」「品質管理業務」「コンサルティング業務」にノウハウを集中する特化型CROとして、製薬会社の真のパートナーを目指し、高品質な治験を支援している。 CRO事業では、治験の最も大切な段階である第II相試験(フェーズII)及び第III相試験(フェーズIII)における「モニタリング業務」に特化している事が特徴。また、統合失調症、うつ病、アルツハイマー等の中枢神経系(Central Nervous System :CNS)領域やがん領域といった難易度の高い領域に注力する事で他社との差別化を図っている(これに対して、生活習慣病等の領域は差別化が難しく受託競争が激しい)。一方、CSO事業では、特定の疾患領域にフォーカスすると共にCRO事業で培ったノウハウを活かし、プロダクトマーケティング業務や製販後データの企画・収集業務の受託を手掛けており、MR派遣が中心の他社のCSO事業と一線を画している。 主な取引先は、武田薬品工業グループ、第一三共、大塚製薬、塩野義製薬、田辺三菱製薬、小野薬品工業等国内主要製薬会社。尚、第II相試験は安全性及び有効性・用法・用量を調べるために実施され、この結果を基に第III相試験において、実際の治療に近い形での効果と安全性を確認する。 【沿革】
2005年6月、藤沢薬品工業株式会社(現 アステラス製薬株式会社)で免疫抑制剤等の開発に携わってきたメンバー9名によって設立された。大阪発理想の医薬品開発受託(CRO)事業を目的として、設立当初から、CNS領域やがん領域の育成に取り組み、会社設立後まもなく大塚製薬からCNS領域の案件を受注。その後、人材を補強し事業部として受注活動を強化した。また、がん領域も外資系製薬会社等でがん領域の医薬品開発を手掛けた人材等に恵まれ、足元、受注が拡大している。SMO(治験施設支援機関)事業進出を念頭に、06年1月に同事業を手掛けるアウローラ(株)を子会社化したが、CRO事業への経営資源集中を図るべく07年5月に全保有株式を売却。08年7月に、国内の製薬会社の米国進出支援を目的に米国カリフォルニア州に全額出資子会社LINICAL USA, INC.を設立。同年10月の東証マザーズ上場を経て、13年3月に東証1部に市場変更となった。13年5月に、台湾と韓国に全額出資子会社LINICAL TAIWAN CO.,LTDとLINICAL KOREA CO.,LTDを設立。14年4月には、LINICAL KOREA CO,,LTDと買収した韓国のCROであるP-pro. Korea Co., Ltd.との統合を完了した。14年10月29日には欧州でCRO事業を展開しているNuvisan CDD Holding GmbHの全株式を取得し子会社化するための株式譲渡契約を、Nuvisan Pharma Holding GmbH との間で締結し、12月1日付けで同社の100%子会社となった。更に、グループとしての一体感の醸成と連携強化を図るため、連結子会社となったNuvisan CDD Germany GmbHの名称をLINICAL Europe GmbHに商号変更した。 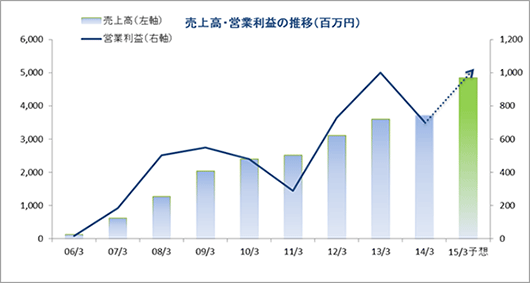 【業務内容】
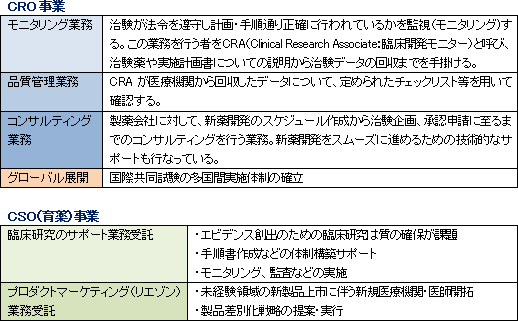
事業セグメントは、主力のCRO事業とCSO事業に分かれ、14/3期の売上構成比は、それぞれ92.3%、7.7%。CRO事業は「モニタリング業務」に特化しており、これに付随する「品質管理業務」や「コンサルティング業務」も手掛ける。一方、CSO事業は、臨床研究のサポート業務受託やプロダクトマーケティング業務の受託を手掛け、MR派遣を中心とする他社と差別化を図っている。
 【強み】
(1)知識・ノウハウ・経験等の専門性を集中し製薬会社の様々なニーズに対応
1つの新薬が開発・承認され市場で販売されるまでには 10~18年もの長い歳月を要する。 その中でも、3~7年の期間を要する治験では、準備不足やデータ不備、思わぬトラブルのために往々にしてスケジュールが遅れ、販売遅延の原因になる場合がある。 同社は経験豊かなCRAがオリエンテーションの段階から臨床開発におけるプロセスを見通し、「いかにしてスムーズに進められるか」を考え、予測できる問題を未然に防ぎ、高精度のデータをスピーディーに収集するノウハウを持っている。更に、同社は事業特化型CROとして、経営効率の高い下記の3業務へ特化していることころに特徴がある。① 開発のコアである3つの業務(「モニタリング業務」「品質管理業務」「コンサルティング業務」)に特化し、100%社内で受託する体制を整備。 ② 治験の中でも特に重要な2つの試験段階(「第II相・第III相試験」)に特化。 ③ 豊富な医薬品開発情報を有する大手製薬会社に特化。 (2)難易度が高く競争相手が少ないがん領域や中枢神経系領域のモニタリング業務に強み
難易度が高く競争相手が少ないがん領域や中枢神経系領域のモニタリング業務に強みを有する。例えば、がん領域であれば、薬の副作用によるものか、がんの進行によるものか、安全性評価が難しく、中枢神経系領域であれば、例えばアルツハイマー病の患者は問診等による薬の有効性評価が難しいため、モニタリングでは高度な対応が必要とされる。この他、急性疾患や特定疾患(いわゆる難病)と呼ばれる領域も難易度が高い分野で、がん領域や中枢神経系領域と共に新薬開発が活発だ(しかし、対応できるCROは限られる)。一方、生活習慣病の治験は患者の状態が比較的安定しており、有効性評価についても比較的容易であるため、難易度は低い(例えば、糖尿病では血糖値の測定データの収集が中心)。新薬の開発トレンドは生活習慣病から治療満足度が低いがん領域や中枢神経系領域にシフトしているが、上記の通り、がん領域では安全性情報の取り扱いが難しく、中枢神経系領域では有効性評価の標準化が難しい。このため、これまでは製薬会社が社内で対応していたが、近年、こうした難易度の高い領域でもアウトソーシングされるケースが増えている。同社にとって、中枢神経系領域は会社設立時からの注力分野であり、がん領域は4年前にアストラゼネカのイレッサ開発メンバーを迎え受注活動を本格化した。 受注残高は、がん領域中心に拡大傾向。 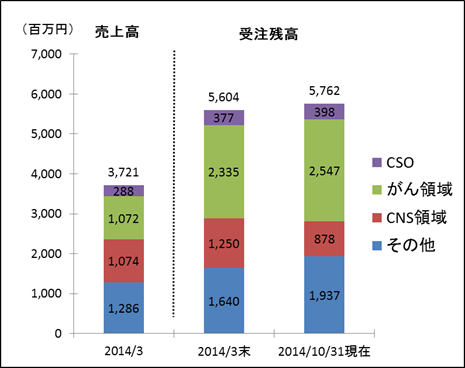 (3)高い収益性
同社が手掛ける案件の逸脱率は非常に低く抑えられており、また、症例の組み入れやデータの回収期間を含め、全案件の8割程度は実施期間の短縮に成功している。同社は難易度の高い分野で高品質・短納期を実現しているため適正価格での受注が可能であり、スケールメリットのハンデを補って、高い利益率を実現している。収益力の源泉となるのがCRAの質だが、同社CRAの質の高さを示す一例として、GCPパスポート認定試験の合格率をあげる事ができる。GCPパスポート認定試験とは、わが国の臨床試験および臨床研究の推進と質の向上を図ることを目的にした試験で、日本臨床試験学会が実施している。なお、同社では受験資格を得た社員はすべて受験をしており、第8回目の合格率は100%となった。 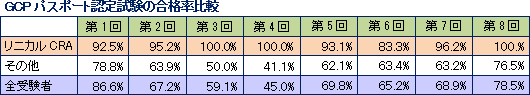  |
| 経営戦略 |
|
(1)CRO事業
CRO事業は第II相試験、第III相試験における「モニタリング業務」に特化し、また、がん領域や中枢神経系領域といった難易度の高い領域で評価を得ている。引き続き高難易度領域で実績の積み上げを図ると共に、事業の拡大に向けCRAを増員していく。国内はCRA 270名が常時稼働できる体制を早期に確立する。
 LINICAL Europeの展開
新たに連結子会社となったLINICAL Europe GmbH(旧Nuvisan CDD Germany GmbH)は、欧州の主要各国でCROの事業を行っているため、同社グループの受託体制が飛躍的に強化、拡充されグローバルによるワンストップサービスが可能となる。LINICAL Europe GmbHの子会社は、ドイツ、スペイン、フランス、オランダ、クロアチアに所在し、それら隣国でのモニタリングサービスを提供している。これにより、同社グループがサービスを提供できる国は、パートナー経由も含めると40カ国前後まで一気に拡大することとなる。新たに誕生したLINICAL Europeグループの人員は約110人程度の予定。(買収後の構成図) 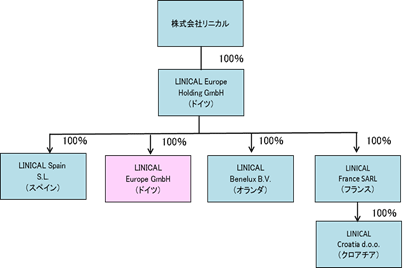 (2)CSO(育薬)事業
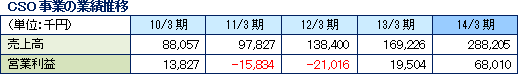
他社が手掛けるMRの派遣サービスとは一線を画し、同社が主体となって業務を進める受託サービス型のCSO(育薬)事業を志向している。具体的には、特定の疾患領域やエリアで経験豊富なMRを採用し、CRO事業部で蓄積したノウハウを活用する事で専門性の高い業務を受託し差別化を図っていく考えで、現在、臨床研究のサポート業務受託とプロダクトマーケティング(リエゾン)業務と業務受託が2本柱。13/3期は臨床研究の受託に成功し、セグメント損益が黒字転換し、14/3期は臨床研究等の新規受注により売上・利益ともに前期比増加となった。
  (3)創薬支援事業(新規事業の育成)
短期業績に影響の少ない新薬開発スキーム、アジア諸国のドラックラグ化合物の積極的な開発、更には開発計画作成から申請までのワンストップ委託といった昨今のニーズへの対応を念頭に創薬支援事業を育成していく。このため、治験実施計画書作成、データ回収以降の業務を含む案件の戦略的な受託と経験の拡充に取り組むとともに、助成金/創薬ファンドの活用による早期段階に限定した化合物の自社開発を行うことを計画している。こうした創薬ファンドを活用した化合物の開発は、今後の同社のCRO事業の拡大に繋がるとともに、これまでの経験で同社が培ってきた目利きの力が生かされる。更に、開発計画立案から承認申請までの受託経験が蓄積される。
|
| 2015年3月期第2四半期決算 |
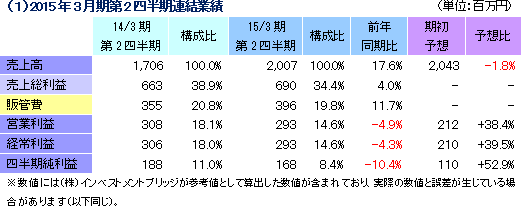 前年同期比17.6%の増収、同4.3%の経常減益
売上高は前年同期比17.6%増の20億7百万円、経常利益は同4.3%減の2億93百万円となった。同社が属するCRO事業とCSO事業の業界は、既存企業の規模拡大、事業譲渡、廃業などによる業界再編から業界内の競争は激化しているものの、医薬品開発・販売のアウトソーシング化及び、国際共同試験の増加を背景に市場は緩やかに拡大している。 こうした中、売上面では、CRO事業において増加するがん領域及び中枢神経系(CNS)領域の案件の受託体制を強化したことや、CRO事業及びCSO事業において営業活動を強力に推進したことが新規案件の受託に結びつき増収となった。 一方、利益面は、CSO事業において貢献したものの、先行的な人員の採用による人件費の増加やのれん償却額(韓国)の発生によりCRO事業が減少し、全体とし減益となった。新規受託案件に対応するために先行的に人員を採用し教育を行っていることから、一時的にCRAの稼働率が低下し、利益率が低下している。売上総利益率は34.4%と前年同期比4.5ポイント悪化した一方、売上高対販管費率は、19.8%と同1ポイント低下した。この結果、営業利益も2億93百万円と同4.9%減少した。その他、為替差益の発生などで営業外損益が若干改善、特別損益の大きな計上はなかった。海外子会社における税負担の影響により、四半期純利益は、同10.4%の減益となった。 期初の会社予想に対し、売上は概ね会社計画並みとなったものの、中途採用に係る人材採用費、人件費、M&A費用が下期以降にずれ込んだ影響で、利益は会社計画を大幅に上回った。 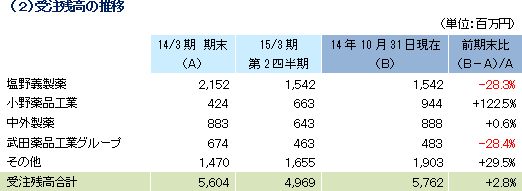 アウトソーシング化及び国際共同試験の増加を背景に足元の受注環境は良好であり、営業活動の成果により既存・新規顧客からの受託案件の打診が多いことから、同社ではCRA(臨床開発モニター)の増員などにより、受託体制の強化を図る計画。 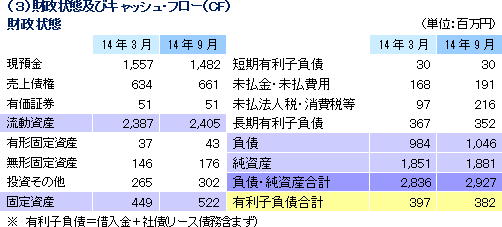  |
| 2015年3月期業績予想 |
 前期比30.2%の増収、同44.9%の経常増益予想。
15/3期の会社計画は、売上高が前期比30.2%増の48億46百万円、経常利益が同44.9%増の10億20百万円の期初予想から変更なし。売上面では、CRO事業については、創業以来から高い評価を受けている既存顧客のリピート受注に加え、顧客ニーズの高いがん領域及びCNS領域を中心にグローバル案件を含む新規案件の受注を見込んでいる。また、CSO事業についても、新規顧客に対する営業活動の強化を図り、CRO事業で得たノウハウを活かした専門性の高い領域での新規案件の受託を目指す。 また、利益面でも、CRA(臨床開発モニター)増員ならびにグローバル展開で原価・販管費は増加するものの、増収効果やCRAの稼働率の向上により前期比大幅な増益を見込む。 1株当たりの配当も、前期と同額の期末配当14円の期初計画を据え置き。 LINICAL Europe(旧Nuvisan CDD Holding GmbH)の買収に関する影響については、現在精査中。今後、業績予想に重要な影響を与えることが明らかとなった場合に、速やかに開示する方針。 |
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




