ブリッジレポート:(2183)リニカル vol.26
| (2183:東証1部) リニカル |
|
||||||||
|
||||||||
企業名 |
株式会社リニカル |
||
社長 |
秦野 和浩 |
||
所在地 |
大阪市淀川区宮原1-6-1 新大阪ブリックビル |
||
決算期 |
3月 |
業種 |
サービス業 |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2015年3月 | 4,872 | 876 | 840 | 437 |
| 2014年3月 | 3,721 | 706 | 703 | 449 |
| 2013年3月 | 3,599 | 1,003 | 998 | 616 |
| 2012年3月 | 3,110 | 728 | 723 | 424 |
| 2011年3月 | 2,512 | 288 | 278 | 147 |
| 2010年3月 | 2,404 | 480 | 473 | 273 |
| 2009年3月 | 2,036 | 549 | 515 | 300 |
| 2008年3月 | 1,273 | 505 | 494 | 296 |
| 2007年3月 | 613 | 186 | 195 | 114 |
| 2006年3月 | 118 | 16 | 19 | 11 |
| 株式情報(2/18現在データ) |
※ROEは前期実績、BPSは16/3期2Q実績、EPSは16/3月期予想。 |
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
医薬品は発売前に厚生労働省の承認・認可を受けることが義務付けられており、承認前の薬剤(医薬品候補)を患者に投与して効果や安全性を確かめる必要がある。これら臨床試験としての治験を支援する企業をCRO(医薬品開発業務受託機関)と呼ぶ。製薬会社は開発要員に制限のある中で機動的な開発を遂行するために、業務をアウトソーシングする動きを拡大しており、CROの役割が大きくなっている。 同社は新薬開発に不可欠な治験の最も大切な段階である「第II相・第III相試験」と、主業務である「モニタリング業務」「品質管理業務」「コンサルティング業務」にノウハウを集中する特化型CROとして、製薬会社の真のパートナーを目指し、高品質な治験を支援している。 CRO事業では、治験の最も大切な段階である第II相試験(フェーズII)及び第III相試験(フェーズIII)における「モニタリング業務」に特化している事が特徴。また、統合失調症、うつ病、アルツハイマー等の中枢神経系(Central Nervous System :CNS)領域やがん領域といった難易度の高い領域に注力する事で他社との差別化を図っている(これに対して、生活習慣病等の領域は差別化が難しく受託競争が激しい)。一方、育薬事業では、特定の疾患領域にフォーカスすると共にCRO事業で培ったノウハウを活かし、プロダクトマーケティング業務や製販後データの企画・収集業務の受託を手掛けており、MR派遣が中心の他社のCSO事業と一線を画している。 主な取引先は、武田薬品工業グループ、塩野義製薬、田辺三菱製薬、小野薬品工業、中外製薬等国内主要製薬会社。尚、第II相試験は安全性及び有効性・用法・用量を調べるために実施され、この結果を基に第III相試験において、実際の治療に近い形での効果と安全性を確認する。 【沿革】
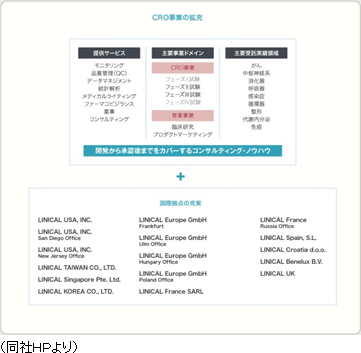
2005年6月、藤沢薬品工業株式会社(現 アステラス製薬株式会社)で免疫抑制剤等の開発に携わってきたメンバー9名によって設立された。大阪発理想の医薬品開発受託(CRO)事業を目的として、設立当初から、CNS領域やがん領域の育成に取り組み、会社設立後まもなく大塚製薬からCNS領域の案件を受注。その後、人材を補強し事業部として受注活動を強化した。また、がん領域も外資系製薬会社等でがん領域の医薬品開発を手掛けた人材等に恵まれ、足元、受注が拡大している。SMO(治験施設支援機関)事業進出を念頭に、06年1月に同事業を手掛けるアウローラ(株)を子会社化したが、CRO事業への経営資源集中を図るべく07年5月に全保有株式を売却。08年7月に、国内の製薬会社の米国進出支援を目的に米国カリフォルニア州に全額出資子会社LINICAL USA, INC.を設立。同年10月の東証マザーズ上場を経て、13年3月に東証1部に市場変更となった。13年5月に、台湾と韓国に全額出資子会社LINICAL TAIWAN CO.,LTD.とLINICAL KOREA CO.,LTD.を設立。14年4月には、LINICAL KOREA CO.,LTD.と買収した韓国のCROであるP-pro. Korea Co., Ltd.との統合を完了した。14年10月29日には欧州でCRO事業を展開しているNuvisan CDD Holding GmbHの全株式を取得し子会社化するための株式譲渡契約を、Nuvisan Pharma Holding GmbH との間で締結し、12月1日付けで同社の100%子会社となった。更に、グループとしての一体感の醸成と連携強化を図るため、連結子会社となったNuvisan CDD Germany GmbHの名称をLINICAL Europe GmbHに商号変更した。 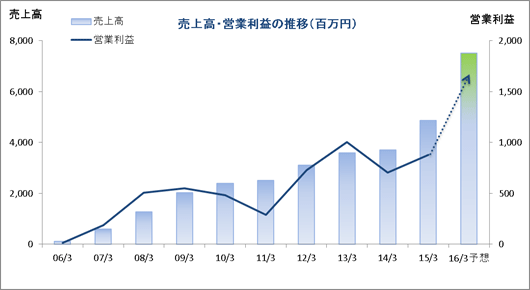 【業務内容】
事業セグメントは、主力のCRO事業と育薬事業(注)に分かれ、15/3期の売上構成比は、それぞれ92.5%、7.5%。製薬会社の医薬品開発における治験業務の一部を受託するCRO事業を中心に展開。また、CRO事業は「モニタリング業務」に特化しており、これに付随する「品質管理業務」や「コンサルティング業務」も手掛ける。一方、育薬事業は、臨床研究のサポート業務受託やプロダクトマーケティング業務の受託を手掛け、MR派遣を中心とする他社と差別化を図っている。(注)16/3期第1四半期連結会計期間より従来のセグメントの名称を「CSO事業」から「育薬事業」へ変更した。 CRO事業
主力のCRO事業においては、新薬の迅速な市場投入につながる高品質で高効率な治験の支援を目指して、高い技術と豊富な経験をもつスタッフが担当にあたっている。今後も拡大するグローバルスタディに対応していくため、アジア(韓国、台湾、シンガポールなど)と欧州、米国に拠点を開設。薬事から企画、実施計画書の作成、モニタリング、データマネージメント、統計解析、ファーマコビジランスまでワンストップで対応。国際共同試験においては、リニカル本社を窓口に位置づけ、各国に医薬品開発事情に精通した人材を配置。日本語ベースで機動的な国際共同治験が可能な開発環境を整えている。10年から20年近くに及ぶ新薬開発プロジェクトの中でも、3年から7年を要するといわれる治験で特に重要とされる患者を対象とする「第II相(フェーズII試験)」「第III相(フェーズIII試験)」のプロセスに特化し、治験の核となる「モニタリング」を「品質管理」「コンサルティング」とともに提供。信頼性の高いデータの収集を行い、迅速、確実な新薬開発の実現を支援している。さらに担当領域も市場からの開発要請の強いがん領域や中枢神経系領域をはじめ難易度の高い領域に特化することで、顧客である製薬会社のニーズに応えている。
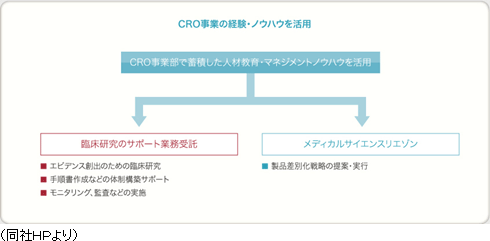
 育薬事業
医薬品承認後の臨床研究は、臨床現場における医薬品使用について有効性の検証、安全性の確認、相互作用の検討等を実施するもので、医療の質の向上に寄与するEBM(Evidence Based Medicine)データを創出。近年、臨床研究についてルール整備が進んでおり、従来の医師主導臨床研究に加え、企業主導臨床研究も多く実施される様になってきている。同社は、治験で培った臨床試験のノウハウに加え、最新の規制情報に対応した臨床研究をグローバルで実施することができ、試験の介入研究のみならず、観察研究、データベース研究と各種の臨床研究の受託が可能。今後、製薬会社においては、営業活動の適正化・透明化に伴い、各疾患領域のKOL(Key Opinion Leader)への意見聴取は、MA部(Medical Affairs)のMSL (Medical Science Liaison)が主体として実施することが予測されている。MSLは、KOLエンゲージメント、アドバイスボードの運営、講演会運営等を多種の業務を実施しており、その育成も重要となってきている。同社は、これまでの営業資材作成、ROL(Regional Opinion Leader)支援、臨床研究の手順書作成支援、コンサルティング業務の経験を生かし、各種MSL業務支援をグローバルで実施。
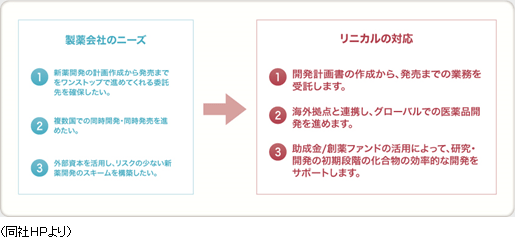
 創薬支援事業
同社が提供するサービスは、治験のモニタリング業務の受託、 新薬の販売支援などにとどまらず、 開発計画の立案や治験計画書作成から発売に至るまでの医薬品開発業務全般に幅広く対応するなど、クライアントである製薬会社のニーズに的確に対応。更に、医薬品開発の初期段階にある、「クスリの種」となるような化合物について、 創薬ファンドや助成金などを活用したリスクの少ない開発の提案を行う。
 【強み】
(1)知識・ノウハウ・経験等の専門性を集中し製薬会社の様々なニーズに対応
1つの新薬が開発・承認され市場で販売されるまでには 10~18年もの長い歳月を要する。 その中でも、3~7年の期間を要する治験では、準備不足やデータ不備、思わぬトラブルのために往々にしてスケジュールが遅れ、販売遅延の原因になる場合がある。 同社は経験豊かなCRAがオリエンテーションの段階から臨床開発におけるプロセスを見通し、「いかにしてスムーズに進められるか」を考え、予測できる問題を未然に防ぎ、高精度のデータをスピーディーに収集するノウハウを持っている。更に、同社は事業特化型CROとして、経営効率の高い下記の3業務へ特化していることころに特徴がある。① 開発のコアである3つの業務(「モニタリング業務」「品質管理業務」「コンサルティング業務」)に特化し、100%社内で受託する体制を整備。 ② 治験の中でも特に重要な2つの試験段階(「第II相・第III相試験」)に特化。 ③ 豊富な医薬品開発情報を有する大手製薬会社に特化。 (2)難易度が高く競争相手が少ないがん領域や中枢神経系領域のモニタリング業務に強み
難易度が高く競争相手が少ないがん領域や中枢神経系領域のモニタリング業務に強みを有する。例えば、がん領域であれば、薬の副作用によるものか、がんの進行によるものか、安全性評価が難しく、中枢神経系領域であれば、例えばアルツハイマー病の患者は問診等による薬の有効性評価が難しいため、モニタリングでは高度な対応が必要とされる。この他、急性疾患や特定疾患(いわゆる難病)と呼ばれる領域も難易度が高い分野で、がん領域や中枢神経系領域と共に新薬開発が活発だ(しかし、対応できるCROは限られる)。一方、生活習慣病の治験は患者の状態が比較的安定しており、有効性評価についても比較的容易であるため、難易度は低い(例えば、糖尿病では血糖値の測定データの収集が中心)。 新薬の開発トレンドは生活習慣病から治療満足度が低いがん領域や中枢神経系領域にシフトしているが、上記の通り、がん領域では安全性情報の取り扱いが難しく、中枢神経系領域では有効性評価の標準化が難しい。このため、これらの領域では同社のように受託実績を有し、経験豊富なメンバーを有するCROに案件が集中する傾向がある。 受注残高は、がん領域、CNS領域、急性疾患や特定疾患などのその他領域で拡大傾向 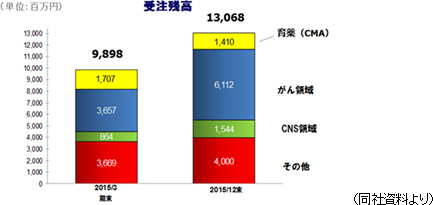 (3)高い収益性
同社が手掛ける案件の逸脱率は非常に低く抑えられており、また、症例の組み入れやデータの回収期間を含め、全案件の8割程度は実施期間の短縮に成功している。同社は難易度の高い分野で高品質・短納期を実現しているため適正価格での受注が可能であり、スケールメリットのハンデを補って、高い利益率を実現している。収益力の源泉となるのがCRAの質だが、同社CRAの質の高さを示す一例として、GCPパスポート認定試験の合格率をあげる事ができる。GCPパスポート認定試験とは、わが国の臨床試験および臨床研究の推進と質の向上を図ることを目的にした試験で、日本臨床試験学会が実施している。なお、同社では受験資格を得た社員はすべて受験をしており、他社と比べると高い合格率を誇っている。 パスポート認定試験とは、わが国の臨床試験および臨床研究の推進と質の向上を図ることを目的にした試験で、日本臨床試験学会が実施している。なお、同社では受験資格を得た社員はすべて受験をしており、他社と比べると高い合格率を誇っている。 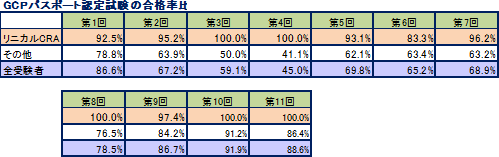 |
| 経営戦略 |
|
(1)CRO事業
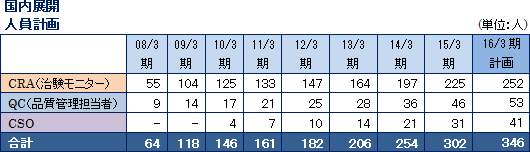
CRO事業の重点戦略は、①がん領域や中枢神経系領域などで実績を積み上げるとともに、リピート受注から独占契約へつなげる、②早期に国内CRA300名体制を構築し、CRAの高稼働率を維持する、③グローバル体制構築による国際共同試験のワンストップ受託を拡大するというもの。
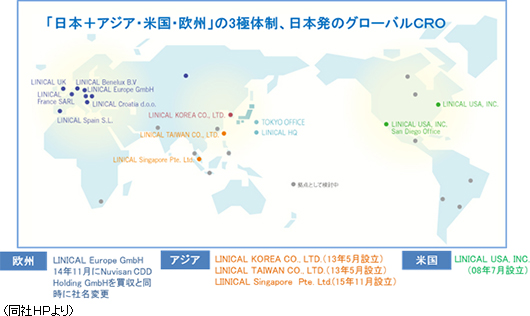
 グローバル展開
グローバルでは、確立した日亜・米・欧州における国際共同試験の受託体制を武器に、今後事業の拡大を加速させる。治験の多国間実施体制の整備の一環として、2013年5月に、LINICAL TAIWAN CO., LTD.(台湾台北市、資本金1千万台湾ドル)、及びLINICAL KOREA CO., LTD.(韓国ソウル特別市、資本金10億ウォン)を設立(いずれも100%出資)。2014年4月には、LINICAL KOREA CO., LTDと買収した韓国のCROであるP-pro. Korea Co., Ltd.との統合を完了した。また、2008年7月に設立したLINICAL USA, INC.(米国ニュージャージー州)は業務拡大を目的として2014年9月にサンディエゴ事務所を設立した。更に、2014年10月29日に欧州でCRO事業を展開しているNuvisan CDD Holding GmbHの全株式を取得し子会社化するための株式譲渡契約を、Nuvisan Pharma Holding GmbH との間で締結し、12月1日付けで完全子会社化が完了、同時に商号をLINICAL Europe GmbHと変更した。これにより日亜・米・欧3極による受託体制が確立された。
  (2)育薬事業
他社が手掛けるMRの派遣サービスとは一線を画し、同社が主体となって業務を進める受託サービス型の育薬事業を志向している。具体的には、特定の疾患領域やエリアで経験豊富なMRを採用し、CRO事業部で蓄積したノウハウを活用する事で専門性の高い業務を受託し差別化を図っていく考えで、現在、臨床研究のサポート業務受託とプロダクトマーケティング(リエゾン)業務受託が2本柱。臨床研究のサポート業務受託は、エビデンス創出のための臨床研究において質の確保が課題となっている。同社では、手順書作成などの体制構築サポートやモニタリング、監査などを実施している。プロダクトマーケティング(リエゾン)業務では、未経験領域の新製品上市に伴う新規医療機関・医師の開拓や製品差別化戦略の提案・実行を行う。13/3期は臨床研究の受託に成功し、セグメント損益が黒字転換し、14/3期以降臨床研究等の新規受注により売上・利益の成長が加速してきた。
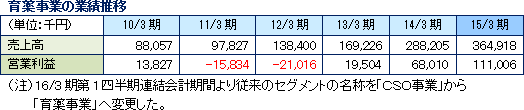 (3)創薬支援事業(新規事業の育成)
製薬会社・バイオベンチャーにおいては、短期業績に影響の少ない新薬開発スキームを構築したい、開発計画作成から申請までワンストップで委託したいというニーズが高まっている。また、患者や台湾と日本の行政当局においては、アジア諸国でドラックラグ化合物の積極的な開発を行って欲しい、がん・痴呆・難治性疾患への新薬の開発や再生医療の実用化を行って欲しいというニーズが高まっている。同社では、こうした昨今のニーズへの対応を念頭に創薬支援事業の育成を目指している。このため、治験実施計画書作成、データ回収以降の業務を含む案件の戦略的な受託と経験の拡充に取り組むとともに、助成金/創薬ファンドの活用による早期段階に限定した化合物の自社開発を行うことを計画している。こうした創薬ファンドを活用した化合物の開発は、今後の同社のCRO事業の拡大に繋がるとともに、これまでの経験で同社が培ってきた目利きの力が生かされる。更に、開発計画立案から当局対応までの受託経験が蓄積される。
|
| 2016年3月期第3四半期決算 |
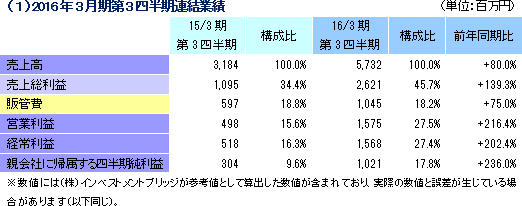 前年同期比80.0%の増収、同202.4%の経常増益
売上高は前年同期比80.0%増の57億32百万円、経常利益は同202.4%増の15億68百万円となった。同社が属するCRO業界とCSO業界は、医薬品開発・販売のアウトソーシング化及び国際共同試験の増加を背景として、市場規模は緩やかに拡大している。 こうした中、売上面では、日本、アジア、米国、欧州におけるグローバル受託体制の構築を強力に推し進めたことにより、国内案件、海外案件及び国際共同試験のいずれも受注が好調に推移したことからCRO事業が大幅に増加した。育薬事業においても製販後の臨床研究を中心とした案件の受託により増加した。 利益面でも、CRO事業において日本の業績が好調に推移したことに加え、海外子会社の大幅な赤字額の縮小及び黒字化が寄与した。また、育薬事業おいても受託案件の増加により人員の稼働率が上昇したことが利益に貢献した。売上総利益率は45.7%と前年同期比11.3ポイントの大幅な上昇。売上高対販管費率も、18.2%と同0.6ポイント低下した。この結果、営業利益は15億75百万円と同216.4%増加した。 また、営業外収益で為替差益が前年同期比約16百万円減少したことや営業外費用で有価証券評価損8百万円を計上したことなどから経常利益の増益率は低下した。その他、特別損益の計上はなかった。 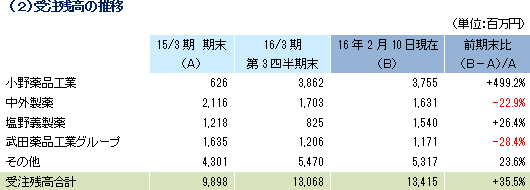 2016年2月10日時点の受注残高は、前期末(2015年3月)に比べ、35.5%増加。これは、既存の受託契約を順調に消化し受注残高の金額が売上高として計上されたものの、これを上回る受託案件の新規契約があったもの。アウトソーシング化及び国際共同試験の増加を背景に足元の受注環境は良好であり、営業活動の成果により既存・新規顧客からの受託案件の打診が多いことから、同社ではCRA(臨床開発モニター)の増員などにより、受託体制の強化を図る計画。 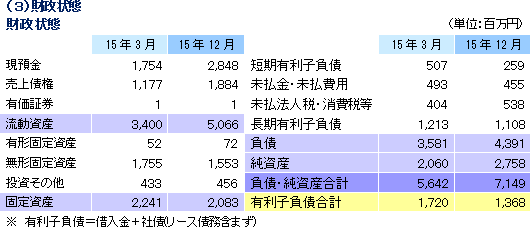 2015年12月末の自己資本比率は38.6%と前期末比約2.1ポイントの上昇となった。 |
| 2016年3月期業績予想 |
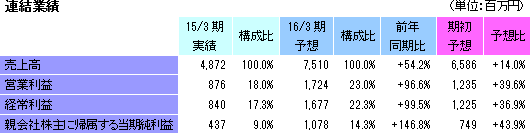 前期比54.2%の増収、同99.5%の経常増益予想。
16年1月29日に16/3期の会社計画の上方修正を実施。新しい会社計画は、売上高が前期比54.2%増の75億10百万円、経常利益が同99.5%の16億77百万円。大手製薬会社は、大型製品の特許切れの影響を補完するため、アウトソーシングによる経営の合理化・効率化並びに有望な医薬品開発品目の確保のため、海外ベンチャー企業の買収などを加速させており、医薬品開発のための治験受託件数は増加するものと予想される。特に、がん領域及び中枢神経系領域においては、いまだに有効な治療法が確立していない疾病があるため、その治療薬の開発が強く望まれており、こうしたニーズに対応するための医薬品開発は増加傾向となっている。 こうした環境下、国内案件、海外案件及び国際共同試験のいずれも受注が好調に推移しておりCRO事業を中心に売上と利益が大幅に増加する見込み。また育薬事業おいても、製販後の臨床研究を中心とした案件の受託により人員の稼働率上昇が見込め、売上と利益が増加する見込み。営業利益は前期比96.6%増の17億24百万円の予想で、売上高営業利益率が約23%と前期比約5%ポイント高まる見込み。なお、連結業績予想において、韓国子会社及び欧州子会社買収に伴うのれん及び無形資産の償却費を125百万円見込んでいることから、償却前の連結経常利益の会社計画は18億3百万円となる見込み。その他、前期に特別損失で計上した退職給付費用が減少することから当期純利益の増益率は同146.8%と高くなる。 また、同社は今期の1株当たり配当金の予想を16年1月29日に1株当たり9円と期初予想の7円から2円の増配へ修正した(2016年1月1日を効力発生日として1:2の株式分割を実施。株式分割を考慮しない場合の期末配当は1株当たり18円となり前期比4円の増配)。 |
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2026 Investment Bridge Co.,Ltd. All Rights Reserved. |




